Необходимо обозначить, что государственный контроль - это сложносоставная функция, главной целью осуществления которой является обеспечение выполнения законодательства Российской Федерации. Для достижения указанной цели при осуществлении государственного контроля должны решаться задачи по предупреждению, выявлению и пресечению нарушений законодательства Российской Федерации. Субъектами государственного контроля являются уполномоченные органы государственной власти и организации, в отношении которых проводятся контрольно-надзорные мероприятия. Следует отметить, что законодательством Российской Федерации в настоящее время перечень видов и форм государственного контроля, связанных с разрешительными функциями государства, и государственного надзора, а также универсальные унифицированные требования к их осуществлению не установлены [2]. Кроме того, отсутствует специализированный и законодательно закрепленный перечень органов исполнительной власти, наделенных контрольно-надзорными полномочиями в отношении фармацевтических организаций. Установлено, что в настоящее время система надзора соблюдения обязательных требований к товарам, работам и услугам на уровне фармацевтических организаций включает множество федеральных органов исполнительной власти с различными полномочиями, т.е. осуществление фармацевтической деятельности может контролироваться целым рядом самостоятельных, независимых друг от друга контролирующих структур, основные из которых представлены на рисунке 1.
Основным контролирующим органом в сфере обращения лекарственных средств является Росздравнадзор, который в рамках государственного контроля производит и лицензирование деятельности, осуществляемой в данной области [3]. Для целей настоящей статьи под лицензированием следует понимать разрешительно-контрольную процедуру, элементами которой являются разрешение на осуществление отдельных видов деятельности и надзор в сфере обращения лекарственных средств. Согласно действующему законодательству среди видов деятельности, подлежащих лицензированию, в сфере обращения ЛС осуществляются фармацевтическая деятельность, производство лекарственных средств, медицинская деятельность, оборот наркотических средств, психотропных веществ и их прекурсоров и культивирование наркосодержащих растений [4].
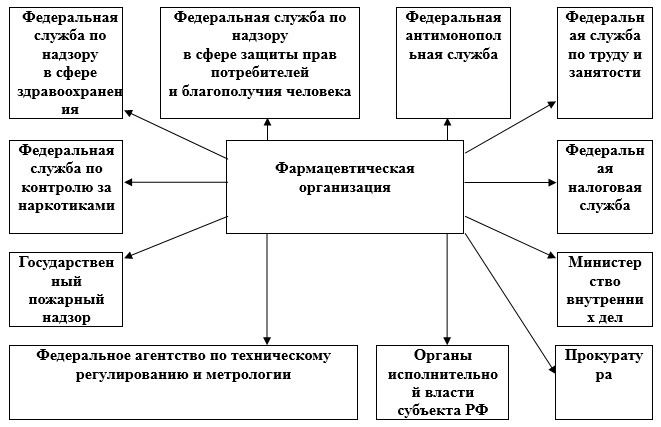
Рис. 1. Структуры, осуществляющие государственный контроль деятельности фармацевтических организаций
Основной целью лицензирования фармацевтической деятельности, на наш взгляд, является предоставление качественной, эффективной, безопасной лекарственной помощи, а также предотвращение нанесения ущерба жизни или здоровью граждан при ее оказании. Для достижения целей лицензирования необходимо соблюдать лицензионные требования, которые основываются на требованиях других нормативных документов и носят императивный характер, т.е. нормы требуют безусловного исполнения. Нормы законодательства и состояние их соблюдения контролируемым лицом на этапе до начала осуществления таким лицом хозяйственной деятельности являются объектами контроля. Результатом контроля в данном случае выступает предоставление или отказ в предоставлении государством права совершать какие-либо виды деятельности, а также последующий контроль соблюдения требований предоставления такого разрешения, а в случае нарушений таких норм - принятие мер воздействия, вплоть до аннулирования выданного разрешения. Кроме того, объектом контроля является деятельность проверяемого лица по обеспечению соблюдения норм законодательства в ходе осуществления им той или иной деятельности. В ходе проверки обязательно проводится оценка состояния и соответствия используемых проверяемыми лицами объектов, продукции и других результатов деятельности обязательным требованиям, понятие которых определено законодательством [5], выявляются нарушения обязательных требований, виновные лица, ответственные за такие нарушения, оцениваются масштабы потенциального и фактического причинения вреда и его последствий. Результатом такого контроля является принятие мер корректирующего характера, а также мер по пресечению, предупреждению нарушений и наказанию виновных лиц. Составляющей указанного контроля является также мониторинг (систематическое наблюдение, анализ, оценка и прогнозирование) состояния соблюдения требований законодательства и подготовка предложений, при необходимости, по его корректировке. Таким образом, в первой форме государственного контроля реализуются разрешительные функции, осуществляемые государственными органами исполнительной власти, такие как лицензирование. Ко второй форме государственного контроля следует относить его специальную форму - государственный надзор.
В результате нашего исследования было установлено, что многочисленность источников правового регулирования фармацевтической деятельности, их разноотраслевая принадлежность, неоднозначная трактовка отдельных норм и правил, противоречия в различных нормативных документах приводят к затруднениям изучения и соблюдения данных норм, а зачастую и к нарушениям обязательных и лицензионных требований фармацевтическими работниками при организации практической деятельности. Следует отметить, что Кодексом об административных правонарушениях предусмотрены различные виды административных наказаний за нарушение как обязательных, так и лицензионных требований, которые могут нанести ощутимый экономический ущерб деятельности фармацевтического бизнеса, вплоть до приостановления его деятельности. Важно заметить, что в настоящее время наблюдается тенденция перехода государственного контроля на риск-ориентированную модель, что предполагает возрастание роли самоконтроля деятельности на уровне организации и повышения ответственности специалистов за соблюдение установленных норм и правил. Вышесказанное определяет необходимость формирования концептуальных направлений в деятельности фармацевтических организаций с позиций государственного контроля, в том числе и лицензирования на основе систематизации и конкретизации требований нормативных правовых документов, регулирующих деятельность фармацевтических организаций по различным критериям, таким как органы государственного контроля, категории проверки и лицензионные требования. В целях настоящей статьи под категориями проверки следует понимать объекты деятельности, в отношении которых проводится оценка соответствия установленным требованиям. Практическое значение данной концепции может быть реализовано посредством разработки руководства по исполнению обязательных и лицензионных требований, включая формирование проверочных листов для самоанализа деятельности фармацевтической организации и разработку индикаторов для оценки соответствия фармацевтической деятельности. В настоящее время учеными Пермской государственной академии совместно со специалистами практической фармации проводится активная работа по разработке методического обеспечения исполнения обязательных и лицензионных требований при осуществлении фармацевтической деятельности. Нами установлены органы контроля, осуществляющие в рамках своих полномочий надзор деятельности фармацевтических организаций, и определены категории проверки. По нашему мнению, требования нормативных документов, регламентирующих деятельность фармацевтических организаций, с позиций контроля можно сгруппировать по следующим категориям проверки:
- помещение и оборудование;
- виды работ, осуществляемые в рамках лицензии (оптовая торговля, розничная торговля, отпуск лекарственных препаратов (ЛП), изготовление ЛП, хранение лекарственных средств (ЛС), хранение ЛП, перевозка ЛС (ЛП));
- персонал;
- реализуемые товары;
- документы, используемые при осуществлении деятельности;
- бухгалтерская отчетность и др.
В отношении каждой из вышеперечисленных категорий может быть проведена оценка их соответствия обязательным требованиям различными органами контроля. Так, например, оценка соответствия помещения и оборудования фармацевтической организации может быть проведена Роспотребнадзором, Росздравнадзором, лицензирующим органом, Госпожнадзором, а также Федеральной службой по контролю за наркотиками. В отношении категории «персонал» проверки осуществляют Росздравнадзор, лицензирующий орган, Роспотребнадзор, Федеральная служба по контролю за наркотиками и Роструд.
Как было замечено ранее, обязательные и лицензионные требования определены множеством нормативных документов. В связи с этим нами проведена систематизация нормативной правовой базы по субъектам и категориям проверки, а также конкретизированы лицензионные требования в разрезе действующих норм и правил. Примеры результата конкретизации лицензионных требований, которые необходимо соблюдать аптечным организациям при осуществлении фармацевтической деятельности, представлены в таблице.
Таблица 1
Примеры конкретизации лицензионных требований в разрезе действующих нормативных документов
|
Лицензионное требование |
Нормативные документы |
Примеры требований |
|
Наличие помещений и оборудования, принадлежащих ему на праве собственности или на ином законном основании, необходимых для выполнения работ (услуг), которые составляют фармацевтическую деятельность (ФД), соответствующих установленным требованиям |
Федеральный закон от 24.11.1995 № 181-ФЗ «О социальной защите инвалидов в РФ» |
|
|
Приказ МЗ РФ от 21.10.1997 г. № 309 «Об утверждении инструкции по санитарному режиму аптечных организаций (аптек)» |
|
|
|
Приказ Минздравсоцразвития России от 23.08.2010 г. № 706н «Об утверждении правил хранения ЛС» |
|
|
|
Соблюдение лицензиатом, осуществляющим розничную торговлю ЛП для МП:
установленных предельных размеров оптовых надбавок к фактическим отпускным ценам производителей на ЛП, включенные в перечень жизненно важнейших и необходимых ЛП |
Приказ Минздравсоцразвития России от 14.12.2005 г. № 785 «О порядке отпуска ЛС»
|
|
|
Приказ Минздравсоцразвития России № 562н от 17 мая 2012 г. «Об утверждении Порядка отпуска физическим лицам лекарственных препаратов для медицинского применения, содержащих кроме малых количеств наркотических средств, психотропных веществ и их прекурсоров другие фармакологические активные вещества» |
а) эрготамина гидротартрат в количестве до 5 мг (на 1 дозу твердой лекарственной формы); б) эфедрина гидрохлорид в количестве до 100 мг (на 100 мл или 100 г жидкой лекарственной формы для внутреннего применения)... |
|
|
Приказ Минздрава России от 22.04.2014 № 183н «Об утверждении перечня лекарственных средств для медицинского применения, подлежащих предметно-количественному учету»
|
|
|
|
Приказ Минздрава России от 17.06.2013 № 378н «Об утверждении правил регистрации операций, связанных с обращением ЛС для МП, включенных в перечень ЛС для МП, подлежащих ПКУ, в специальных журналах учета операций, связанных с обращением ЛС для МП, и правил ведения и хранения специальных журналов учета операций, связанных с обращением ЛС для МП» |
|
|
|
Постановление Правительства РФ от 09.06.2010 г. № 419 «О представлении сведений о деятельности, связанной с оборотом прекурсоров наркотических средств и психотропных веществ, и регистрации операций, связанных с их оборотом» |
|
Следует отметить, что учеными Пермской фармацевтической академии работа в данном направлении активно продолжается и внедряется в практическую деятельность.
Таким образом, данные исследования в период перехода действующей системы государственного контроля на риск-ориентированную модель актуальны и своевременны. По нашему мнению, предлагаемая концепция организации фармацевтической деятельности в системе государственного контроля может выступать основой для практической реализации специалистами сферы обращения лекарственных средств государственных требований на современном этапе развития общества.
Рецензенты:
Белоногова В.Д., д.фарм.н., профессор, зав. кафедрой фармакогнозии с курсом ботаники ГБОУ ВПО «Пермская государственная фармацевтическая академия» Минздрава России, г. Пермь;
Олешко О.А., д.фарм.н., профессор кафедры фармацевтической технологии ГБОУ ВПО «Пермская государственная фармацевтическая академия» Минздрава России, г. Пермь.



