Проблема постарения населения актуальна для разных отраслей хозяйства и знаний. С возрастом происходит «накопление» хронических заболеваний, отмечается множественность патологических процессов. В среднем у людей старше 60 лет устанавливается не менее 3–4 заболеваний. Каждые последующие 10 лет к ним прибавляется еще по 1–2 болезни. Начало заболеваний, формирующих синдром полиморбидности, как правило, приходится на средний возраст. Пожилой и старческий возраст – это период клинических проявлений комплекса заболеваний [5,3]. В последние годы особое внимание уделяется участию в патологических процессах нейроиммуноэндокринной системы [4]. Изучаются основные гормоны диффузной нейроиммуноэндокринной системы при климаксе, в частности мелатонин [1, 2]. Однако данные вопросы во взаимосвязи с развитием полиморбидной патологии изучались мало, что делает направление настоящего исследования актуальным.
Цель работы – выявить нейроиммуноэндокринные особенности у женщин пожилого возраста при различных вариантах течения климакса и различном сочетании соматической патологии.
Материал и методы. Нами было обследовано 304 женщины, из них 256 пациенток пожилого возраста от 60 до 64 лет. Средний возраст составил 62,3+0,9 года. Было сформировано 2 основные группы: первая – с физиологическим климаксом, вторая – с климактерическим синдромом (т.е. патологическим климаксом). Оценка климактерического синдрома проводилась при помощи индекса Куппермана в модификации Е. В. Уваровой. Каждая группа в зависимости от соматической патологии была подразделена на 4 подгруппы: 1 – женщины с отсутствием сердечно-сосудистой и выраженной прочей соматической патологией; 2 – женщины, страдающие артериальной гипертензией 1 или 2 степени; 3 – женщины, страдающие ИБС в виде стабильной стенокардии I–II функционального класса; 4 – женщины с сочетанием артериальной гипертензии 1 или 2 степени и ИБС в виде стабильной стенокардии I–II ФК. Контрольную группу составили 48 женщин среднего возраста в возрасте от 46 до 53 лет, средний возраст составил 50,1+1,4 года. Уровни показателей оксидативного стресса (изучение содержания МДА, SH-группы и их соотношение) и фактора некроза опухолей – альфа определяли при помощи ферментативного метода с применением стандартных реактивов на биохимических автоанализаторах FP-901 «Labsystem» (Франция), «Harizon» (Канада).
Результаты и обсуждения
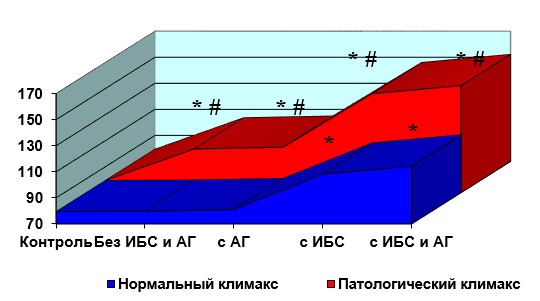
При сравнении состояния цитокинового статуса в процессе полиморбидного континуума у женщин с физиологическим и с патологическим климаксом были выявлены следующие закономерности (рис. 1).
Само по себе наличие патологического климакса уже коррелировало с цитокиновым дисбалансом по показателям ФНО-а в сыворотке крови: 79,7+4,1 и 103,6+2,8 пг/мл у женщин с физиологическим и патологическим климаксом, соответственно (p<0,05).
Формирование артериальной гипертензии коррелировало с увеличением уровня ФНО-а в обеих группах женщин. Но в большей мере это касалось женщин с патологическим климаксом: значение ФНО-а в сыворотке крови 81,0+4,9 и 104,9+3,7 пг/мл у женщин с физиологическим и патологическим климаксом, соответственно (p<0,05).
В обеих группах ситуация еще больше усугублялась при наличии ИБС. Кроме того, при ИБС цитокиновый статус по показателю ФНО-а был хуже у женщин с патологическим климаксом: значение ФНО-а в сыворотке крови составило 108,2+3,2 и 146,0+3,1 пг/мл у женщин с физиологическим и патологическим климаксом, соответственно (p<0,05).
Такая же ситуация наблюдалась и при сочетании ИБС с артериальной гипертензией. Значение ФНО-а в сыворотке крови было 114,4+5,1 и 152,2+4,0 пг/мл у женщин с физиологическим и патологическим климаксом, соответственно (p<0,05).
А – динамика ФНО-а, пг/мл
Б – динамика ИЛ-8, пг/мл
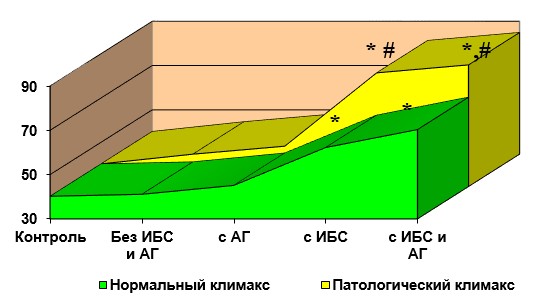
Рис. 1. Цитокиновый статус при полиморбидном континууме.
* p<0,05 по сравнению с контрольной группой;
#p<0,05 по сравнению с женщинами с нормальным наступлением климакса
В отношение цитокинового статуса по показателям ИЛ-8 наблюдалась несколько другая закономерность. Само по себе наличие патологического климакса не влияло на цитокиновый дисбаланс по показателю ИЛ-8 (в отличие от корреляции с ФНО-а): 41,1+5,2 и 44,6+3,9 пг/мл у женщин с физиологическим и патологическим климаксом, соответственно (p>0,05).
Также на это не влияло и формирование артериальной гипертензии: значение ИЛ-8 в сыворотке крови было 45,1+3,3 и 48,2+4,0 пг/мл у женщин с физиологическим и патологическим климаксом, соответственно (p<0,05).
А вот при наличии ИБС в обеих группах ситуация усугублялась при наличии ИБС. Причем, при ИБС цитокиновый статус по показателю ИЛ-8 был хуже у женщин с патологическим климаксом: значение ФНО-а в сыворотке крови было 62,2+3,2 и 81,3+1,2 пг/мл у женщин с физиологическим и патологическим климаксом, соответственно (p<0,05).
Такая же неблагоприятная ситуация наблюдалась и при сочетании ИБС с артериальной гипертензией. Причем, в большей степени неблагоприятное состояние цитокинового статуса было выражено у женщин с патологическим климаксом: значение ИЛ-8 в сыворотке крови было 70,3+2,5 и 84,9+3,0 пг/мл у женщин с физиологическим и патологическим климаксом, соответственно (p<0,05).
Анализ оксидативного статуса показал, что у женщин с физиологическим климаксом не наблюдалось его изменения по сравнению с женщинами из контрольной группы (p>0,05, табл. 1).
Таблица 1
Содержание маркеров оксидативного стресса в сыворотке крови у женщин с физиологическим климаксом
|
Исследуемый показатель |
Средние значения у пациенток контроль-ной группы, (M+m) |
Средние значения у пациенток 1-й группы, подгрупп 1.1-1.4 (M+m) |
|||
|
Подгруппа 1.1 (без ИБС и АГ) |
Подгруппа 1.2 (с АГ) |
Подгруппа 1.3 (с ИБС) |
Подгруппа 1.4 (с АГ+ИБС) |
||
|
МДА (мкмоль/л) |
31,1±1,4 |
32,5±1,3 |
44,0±1,4* |
43,1±2,3* |
43,8±1,7* |
|
SH (мкмоль/л) |
315,4±9,4 |
316,2±10,3 |
282,2±5,1* |
291,1±6,1* |
286,6±7,6* |
|
SH / МДА |
9,77±0,3 |
9,74±0,4 |
6,65±0,4* |
6,88±0,2* |
6,92 ±1,1* |
* p<0,05 по сравнению с контрольной группой.
При формировании артериальной гипертензии, наличии ИБС или их сочетании наблюдались явления окислительного дисбаланса: повышался уровень МДА, снижался уровень SH-групп и, соответственно, уменьшался коэффициент SH/МДА (p<0,05). Причем, степень этих изменений была примерно одинаковой у пациенток с артериальной гипертензией, с ИБС и с их сочетанием.
У женщин с патологическим климаксом также не наблюдалось изменения оксидативного статуса по сравнению с женщинами из контрольной группы (p>0,05, табл. 18). Так же, как и у женщин с физиологическим климаксом, при формировании артериальной гипертензии, наличии ИБС или их сочетании наблюдались явления окислительного дисбаланса: повышался уровень МДА, снижался уровень SH-групп и, соответственно, уменьшался коэффициент SH/МДА (p<0,05). Причем, при сочетании ИБС и артериальной гипертензии эти изменения были более выражены, чем при наличии одной патологии (p<0,05). Более того, анализ данных, приведенных в таблицах 1 и 2, показал, что степень окислительного дисбаланса при патологическом климаксе при сочетании артериальной гипертензии и ИБС была выражена в большей мере, чем в этой же ситуации у женщин с физиологическим климаксом (p<0,05).
Таблица 2
Содержание маркеров окислительного стресса в сыворотке крови у женщин с патологическим климаксом
|
Исследуемый показатель |
Средние значения у пациенток контроль-ной группы, (M+m) |
Средние значения у пациенток 1-й группы, подгрупп 2.1-2.4 (M+m) |
|||
|
Подгруппа 2.1 (без ИБС и АГ) |
Подгруппа 2.2 (с АГ) |
Подгруппа 2.3 (с ИБС) |
Подгруппа 2.4 (с АГ+ИБС) |
||
|
МДА (мкмоль/л) |
31,1±1,4 |
33,7±1,4 |
46,1±1,3* |
45,2±2,0* |
55,7±1,6*,# |
|
SH (мкмоль/л) |
315,4±9,4 |
318,1±7,2 |
280,1±4,9* |
278,2±4,2* |
236,2±3,4*,# |
|
SH / МДА |
9,77±0,3 |
9,70±0,6 |
6,63±0,3* |
6,75±0,4* |
4,93 ±0,9*,# |
* p<0,05 по сравнению с контрольной группой;
#p<0,05 по сравнению с контрольной группой и с подгруппами 2.1, 2.2, 2.3.
Изучение показателей оксидативного статуса в сыворотке крови у пожилых мужчин показало следующее. У практически здоровых пожилых мужчин уровень МДА составил 32,5+1,5 мкмоль/л, SH-групп 317,3+6,3 мкмоль/л, коэффициент SH/МДА 9,71+0,7. При наличии артериальной гипертензии эти показатели соответственно составили 44,8+1,4 мкмоль/л, SH-групп 282,4+5,1 мкмоль/л, коэффициент SH/МДА 6,72+0,4, при наличии артериальной гипертензии и ДГПЖ - 45,2+1,9 мкмоль/л, SH-групп 315,8+5,6 мкмоль/л, коэффициент SH/МДА 6,73+0,6 (p<0,05 для всех показателей по сравнению со здоровыми мужчинами). Такие показатели оксидативного статуса достоверно не отличались от таковых у аналогичных подгрупп женщин с физиологическим климаксом (p>0,05). Однако они достоверно отличались в сторону более легкого течения оксидативного стресса по сравнению с женщинами, имеющими сочетание артериальной гипертензии и ИБС на фоне патологического климакса (p<0,05). Это позволяет рассматривать патологический климакс как состояние, усугубляющее течение оксидативного стресса.
Заключение. В формировании полиморбидного континуума в отношении рассматриваемой патологии «здоровье – климакс – факторы риска развития соматической патологии – развитие соматической заболевания (артериальная гипертензия или ИБС) – формирование полиморбидности (артериальная гипертензия и ИБС)» самостоятельное значение имел как патологический климакс сам по себе, так и нарушение цитокинового статуса при сердечно-сосудистой патологии.
Можно констатировать, что патологический климакс коррелировал с дисбалансом ФНО-а. Это предрасполагало к формированию артериальной гипертензии, который в свою очередь усугублял цитокиновый дисбаланс, особенно при формировании на фоне артериальной гипертензии ИБС. Сам по себе патологический климакс не был связан с дисбалансом ИЛ-8 при исходном отсутствии сердечно-сосудистой патологии. А вот при наличии ИБС включались механизмы, связанные с дисбалансом ИЛ-8, причем в большей степени они оказывались выраженными на фоне патологического климакса.
Таким образом, патологический климакс изначально коррелировал с определенными цитокиновыми нарушениями и способствовал реализации других при развитии патологии. В результате формировались «порочные» круги, что вело к повышению вероятности развития новой патологии, и, следовательно, к формированию полиморбидности. Причем, в этом участвовали и процессы, связанные с окислительным стрессом. Если сам по себе патологический климакс существенно не влиял на оксидативный статус, то при наличии сердечно-сосудистой патологии он являлся фактором, при котором механизмы развития оксидативного дисбаланса реализовывались в большей мере, чем у женщин с физиологическим климаксом.
Рецензенты:
Кветной И.М., д.м.н., профессор, руководитель отдела патоморфологии ФГБНУ «НИИ акушерства, гинекологии и репродуктологии им. Д.О. Отта», г. Санкт-Петербург;
Козлов К.Л., д.м.н., профессор, руководитель отдела клинической геронтологии Санкт-Петербургского института биорегуляции и геронтологии, г. Санкт-Петербург.



