1. Методика двойных эмульсий: формирование первичной эмульсии путем добавления ФНЧ в раствор липидов, которая затем упаривается на роторном испарителе для удаления органического растворителя, с дальнейшей дополнительной обработкой ультразвуком (сонификация) и/или продавливание ее через фильтры нанодиапозона (экструзия).
2. Методика регидратации тонких пленок: получение тонких липидных пленок при удалении органического растворителя из липосомальной дисперсии (дегидратация на роторном испарителе) с последующей регидратацией липидных пленок водным буфером, содержащим ФНЧ, а также сонификация и/или экструзия [3].
Любой химический препарат должен быть охарактеризован по ряду специфических свойств, которые необходимо знать при выполнении поставленных целей и задач в научно-исследовательской работе. При этом в литературе мы не встретили сравнения этих вариантов получения липосом, а также изменения физико-химических и фармацевтических свойств контейнеров в зависимости от метода их получения.
Цель работы
Изучить физико-химические и фармацевтические свойства магнитных липосом, полученных разными методами.
Материалы и методы исследования
МЛ получали из яичного фосфотидилхолина (ФХ) и холестерина (ХС) (Sigma Aldrich, США), а также ФНЧ. ФНЧ — это коллоидный раствор магнетита Fe3O4 со средним диаметром частиц 13,5±4,1 нм, концентрация магнетита в пересчете на Fe3O4 2,76 мг/л. Магнитные частицы получали соосаждением магнетита из растворов сульфата железа (II) и хлорида железа (III) в щелочной среде с последующей стабилизацией цитратом натрия. Манипуляции с липидами и ФНЧ выполняли в атмосфере азота.
В ходе работы магнитные липосомы получали по методу обращения фаз 2 способами.
Первый способ. Коллоидный раствор магнетита добавляли к раствору липидов в соотношении 1:4 по объему (0,138 мг Fe3O4 на 1 мг суммарных липидов), затем полученную смесь упаривали на роторном испарителе. Регидратировали суспензию деионизированной дистиллированной водой. Полученную суспензию подвергали «озвучиванию» в течение 15 мин с частотой ≈ 25 кГц (УЗ-установка «Сапфир-1,3», Россия). После сонификации в образец добавляли 0,9%-ный раствор хлорида натрия, центрифугировали при 1000 g в течение 10 мин для выпадения в осадок ФНЧ, которые отбрасывали.
Второй способ. Липиды (ФХ и ХС в молярном соотношении 10:1) растворяли в хлороформе до концентрации 5 мг/мл в пересчете на суммарные липиды; затем растворитель упаривали на роторном испарителе Laborota 4000 eco (Heidolph, Германия). Липидную пленку получали гидратацией раствором коллоидного магнетита в течение 30 мин при 40°С (соотношение липиды: магнетит 1:0,14 по массе). Таким способом получали эмульсию мультиламеллярных липосом с инкорпорированными коллоидными частицами магнетита. Последующие этапы обработки (сонификация, центрифугирование) проводились аналогично первому варианту.
Стабильность (степень агрегации) оценивалась по изменению среднего диаметра частиц в растворе в динамике: непосредственно в день приготовления и через 2, 7, 14 и 20 суток. Суспензию магнитных липосом хранили при температуре 4°С. Размер липосомальных частиц определяли методом динамического светорассеяния (анализатор NANO-flex, Microtrac, CША). Количество включившегося магнетита в липосомы определяли фотоколориметрическим методом (спектрофотометр УФ и видимой области UV-2600 SHIMADSU, Япония).
Результаты исследования и их обсуждение
Суспензии МЛ, полученные по первому способу, отличались негомогенностью: сразу после приготовления в них выявлялись видимые агломераты и хлопья, которые делали невозможным проведение последующих измерений. Поэтому нами была предпринята попытка улучшить полученные результаты с помощью экструзии МЛ через поликарбонатные фильтры уменьшающегося диаметра (до 100 нм). После экструзии структура суспензии стабилизировалась: однородная, средний размер частиц составлял 133±18 нм.
Уже через 7 суток после хранения наблюдалась частичная преципитация, средний размер частиц в супернатанте составил 228±33 нм.
Через 14 и 21 сутки хранения в суспензии появлялись видимые глазом сгустки, плохо поддающиеся разбиванию при шейкировании. Средний размер частиц составил 1205±456 нм.
Суспензии МЛ, полученные по второму способу, отличались однородностью. Результаты исследования стабильности сравниваемых образцов базовых эмульсий представлены на рисунке 1.
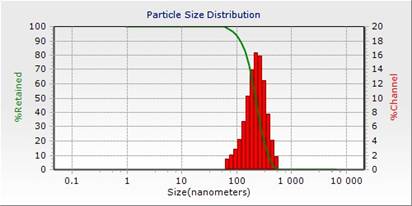
Рис. 1. Распределение по размерам частиц свежей суспензии МЛ
Видно, что cвежие магнитолипосомальные суспензии были достаточно однородными. Средний размер частиц в образцах составлял 182±88 нм.
После 2 суток хранения визуально определяемых изменений суспензий МЛ не наблюдалось, размер частиц составлял 254±94 нм. Как в свежих суспензиях, так и после 2 суток их хранения крупных агрегатов не определялось.
Через неделю хранения в образцах появились признаки дестабилизации в виде расслоения эмульсии. Средний диаметр липосом составил 463±302 нм. Обращало на себя внимание появление дополнительного пика в области 800 нм, связанного с появлением крупных агрегатов частиц липосомальной суспензии (рис. 2). Общее число агрегированных (более 600 нм) частиц в суспензии составило 11,9±2,8%
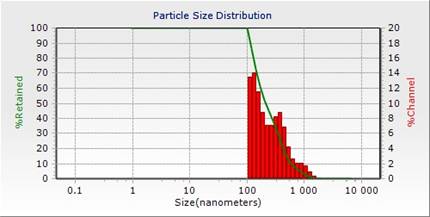
Рис. 2. Распределение по размерам частиц МЛ через 7 суток хранения
Через 14 суток хранения в суспензии появлялись видимые глазом хлопья и сгустки. После встряхивания на шейкере в течение 3 мин хлопья и сгустки разрушались, что позволило провести исследование размеров частиц образца. Средний размер частиц составил 654±337 нм. Происходили уширение основного пика и рост площади дополнительного (рис. 3). Количество агрегированных частиц увеличивалось до 30%.
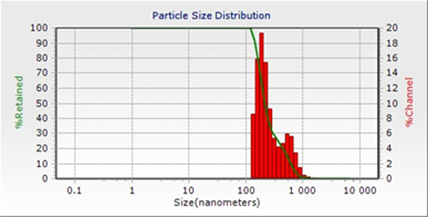
Рис. 3. Распределение по размерам частиц МЛ через 14 суток хранения
Через 21 сутки хранения количество хлопьев в суспензии увеличивалось. Хлопья и сгустки не полностью разрушались при шейкировании, поэтому для определения размеров проводили предварительное центрифугирование суспензии при 1500 g в течение 5 мин и исследовали надосадок. Средний размер частиц составил 955±429 нм. Причем площадь «правого» пика была больше, чем «левого» (рис. 4). Это свидетельствовало о том, что большинство частиц находились в агрегированном состоянии. Доля частиц диаметром более 600 нм была равна 76,5%.
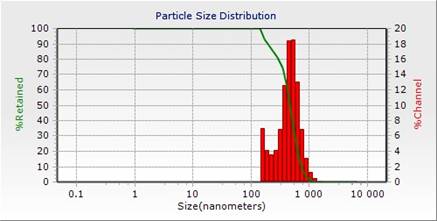
Рис. 4. Распределение по размерам частиц МЛ через 21 сутки хранения
Также нами была проведена сравнительная оценка включения частиц магнетита в липосомы, полученные методом экструзии через поликарбонатные мембраны с размерами пор 200 и 400 нм.
Степень включения оценивали по количеству включенного в липосомы магнетита и рассчитывали по формуле:
ѡ = ((m – m’)/m)∙100%
где m – масса (мг) магнетита взятого на синтез, m’ – масса (мг) магнетита, не включившегося в липосомы.
Результаты представлены в таблице.
Степень включения частиц магнетита в липосомы в зависимости от выбора фильтра
|
Метод экструзии |
Размер пор фильтра, нм |
№ образца |
Масса магнетита, взятого для одного синтеза липосом, мг |
Масса магнетита, включившегося в липосомы(5 мл эмульсии), мг |
Степень включения, % |
Среднее значение |
Стандартное отклонение |
Отн. стандартное отклонение |
|
200 |
1 |
32 |
12,5 |
39 |
38,1 |
0,8 |
1,9 |
|
|
2 |
32 |
11,9 |
37,2 |
|||||
|
3 |
32 |
12,2 |
38,1 |
|||||
|
400 |
1 |
32 |
18,6 |
58,1 |
60,1 |
1,8 |
3,0 |
|
|
2 |
32 |
20 |
62,5 |
|||||
|
3 |
32 |
19,1 |
59,7 |
По результатам анализа эффективности включения частиц магнетита в липосомы пришли к выводу, что увеличение степени включения магнитного компонента с заменой фильтра (с 200 нм на 400 нм) связано с отношением размеров получаемых везикул и частиц магнетита.
Заключение
Метод получения магнитных липосом влияет на их размер и стабильность. Способ изготовления липосом, который подразумевает получение липидной пленки путем испарения органического растворителя из раствора исходных компонентов с последующей ее гидратацией водным раствором, позволяет получить более однородные и стабильные липосомы, а также исключает дополнительный этап экструзии. При этом полученные магнитолипосомальные суспензии стабильны в течение 10 суток хранения при температуре 4°С. В последующем появляются признаки дестабилизации в виде расслоения и образования крупных агрегатов.
Рецензенты:Инчина В.И., д.м.н., профессор, заведующий кафедрой фармакологии и клинической фармакологии с курсом фармацевтической технологии Медицинского института ФГБОУ ВПО «МГУ им. Н.П. Огарева» Минобрнауки России, г. Саранск;
Эпштейн Н.Б., д.ф.н., профессор, заведующий кафедрой фармацевтической и радиофармацевтической химии ИАТЭ НИЯУ «МИФИ» Минобрнауки России, г. Москва.



