Однако в определённых условиях (передозировке, индивидуальной непереносимости) при применении цефоперазона могут возникать различные осложнения со стороны многих органов и систем организма, вплоть до анафилактического шока [6].
Поэтому для установления причин интоксикации лиц, принимавших цефоперазон, решающее значение принимают результаты химико-токсикологического исследования. В то же время, в хирургической практике, нередко возникает потребность проведения аналитического мониторинга концентрации препарата в биологических средах [10].
В литературе наиболее часто встречается информация об использовании ВЭЖХ при анализе цефоперазона [9]. Но в отечественной литературе отсутствуют данные об использовании для количественного анализа цефоперазона в биологических объектах капиллярного электрофореза.
Капиллярный электрофорез находит все более широкое применение в анализе лекарственных средств, в том числе в биологических средах [2,3,7]. Метод характеризуется доступностью для аналитических лабораторий (выпускаются отечественные сертифицированные системы «Капель – 105», «Капель – 105М» фирмы «Люмекс», г. Санкт-Петербург). Из достоинств данного метода необходимо также отметить отсутствие необходимости использования дорогостоящих и высокотоксичных растворителей и малый объём пробы вводимой в кварцевый капилляр (2 – 10 нл). Эффективное решение вопросов количественного определения лекарственных веществ в биологических объектах во многом зависит от важного этапа пробоподготовки (изолирования из объектов, очистки и концентрирования исследуемых соединений).
При разработке методики количественного определения исследуемого соединения в моче с использованием капиллярного электрофореза («Капель-105»), учитывая достаточно большую лабильность цефоперазона при длительном процессе пробоподготовки и содержания значительного количества соэкстрактивных веществ в исследуемых пробах, было предпринято уменьшение объема исследуемой пробы мочи до 0,1 мл. Жидкостно-жидкостное экстракционное концентрирование проводили в экспрессных условиях, исключая процесс упаривания полученного экстракта, с последующим реэкстрагированием исследуемого компонента в рабочий электролит, разбавленный в 10 раз водой. При этом, перевод исследуемого соединения в рабочий электролит, разбавленный в 10 раз, позволяет в процессе электрофореза в кварцевом капилляре дополнительно осуществлять концентрирование пробы за счет приема «стекинга». Концентрирование образца происходит в тот момент, когда заряженные аналиты пересекают границу, которая отделяет зону низкой проводимости раствора и высокой – ведущего электролита. Заряженные аналиты внутри зоны образца движутся с более высокой скоростью, за счет возникновения относительно более высокого электрического поля и, замедляясь на границе с зоной ведущего электролита, концентрируются.
Целью исследования явилось изучение возможности определения цефоперазона в моче капиллярным электрофорезом, с использованием отечественной системы капиллярного электрофореза «Капель – 105».
Материалы и методы исследования
Электрофорез цефоперазона проводили в системе капиллярного электрофореза «Капель-105», содержащий кварцевый капилляр с внутренним диаметром 75 мкм, длиной 65 см, встроенный УФ-спектрофотометрический детектор с изменяемой длиной волны от 190 до 380 нм. Запись и обработка данных проводилась с использованием программного обеспечения «Мультихром для Windows» (ЗАО «Амперсенд», Россия).
Условия электрофореза: рабочий электролит (РЭ) - буферный раствор Бриттона-Робинсона (pH 9,0); растворитель пробы (РП) – РЭ, разбавленный в 10 раз водой; ввод пробы - давлением (30 мБар х15 с); положительный электрод со стороны введения РЭ (напряжение: +20 кВ); детектирование в УФ области спектра, 230 нм.
Последовательная промывка капилляра между анализами осуществлялась: по полной схеме (между первым и четвертым анализами): 0,5 М раствором хлористоводородной кислоты – 10 мин, водой очищенной – 10 мин, 0,5 М раствором натрия гидроксида – 10 мин, водой очищенной – 10 мин, РЭ – 10 мин; проведение холостого электрофореза – 15 мин (положительный электрод со стороны введения РЭ, напряжение: +20 кВ); по короткой схеме (между вторым и третьим анализами): РЭ – 10 мин, проведение холостого электрофореза в тех же условиях, как и по полной схеме.
Запись и обработка данных анализа проводилась с помощью программного обеспечения «Мультихром для Windows».
С целью идентификации цефоперазона на электрофореграмме (ЭФГ), нами рассчитано наблюдаемое время миграции, в минутах (tm).
Методика количественного определения цефоперазона в моче («Капель-105»)
При разработке методики количественного определения цефоперазона готовили градуировочные растворы с содержанием 0,5; 1,0; 5,0; 10,0; 15,0; 20,0 мкг вещества в 1 мл РП. Проводили электрофорез полученных растворов в приведенных выше условиях:
Фотометрические сигналы (площади пиков) использовали для построения калибровочного графика (таблица 1, рис. 1).
Таблица 1
Зависимость фотометрического сигнала от концентрации цефоперазона («Капель – 105», РЭ – буферный раствор Бриттона – Робинсона, рН 9,0)
|
№ п/п |
Цефоперазон, мкг/мл |
Фотометрический сигнал, mAU*сек |
|||
|
mAU*сек |
mAU*сек |
mAU*сек |
mAU*сек ср. |
||
|
1. |
0,5 |
0,091 |
0,094 |
0,118 |
0,101 |
|
2. |
1,0 |
0,209 |
0,203 |
0,206 |
0,206 |
|
3. |
5,0 |
1,143 |
1,168 |
1,152 |
1,154 |
|
4. |
10,0 |
2,257 |
2,318 |
2,367 |
2,314 |
|
5. |
15,0 |
3,443 |
3,266 |
3,281 |
3,333 |
|
6. |
20,0 |
4,311 |
4,476 |
4,325 |
4,370 |
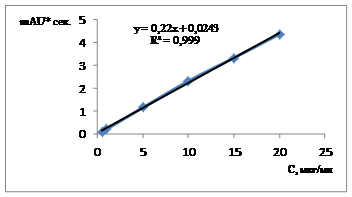
Рис.1. Калибровочный график для количественного определения цефоперазона методом капиллярного электрофореза («Капель-105»)
Результаты исследования показали, что в диапазоне от 0,5 до 20,0 мкг/мл наблюдается линейная зависимость фотометрического сигнала от концентрации цефоперазона. Коэффициент корреляции (R2) составил 0,999, что подтверждает линейность методики. Полученные данные были математически обработаны методом наименьших квадратов и в результате получено линейное уравнение: у = 0,22 х + 0,0243.
Количественное определение цефоперазона в моче.
При разработке методики количественного определения цефоперазона в моче предварительно было изучено влияния рН среды, природы и объема экстрагента, и кратности экстрагирования на степень извлечения вещества из водных растворов. Результаты исследования показали, что максимальное количество цефоперазона экстрагируется органической системой (хлороформ – изобутанол, 3:1) при рН 2,0 и кратности экстрагирования равной 3 [4].
Методика: к 0,1 мл мочи, содержащей определенное количество цефоперазона, добавляли 0,2 мл буферного раствора Бриттона – Робинсона, рН 2,0, и подвергали экстракции органической системой (хлороформ – изобутанол, 3:1), (1мл х 3). Эмульсию разрушали центрифугированием (6000 об/мин., 10 минут), органическую фазу отделяли и осуществляли реэкстрагирование 1 мл РП в течение 10 минут. Смесь центрифугировали (6000 об/мин., 10 минут). Реэкстракт отделяли и осуществляли дегазацию с использованием центрифуги («MiniSpin plus», 10 000 об/мин, 5 минут). Анализ полученных реэктрактов проводили в системе КЭ «Капель-105» в приведенных выше условиях.
Результаты представлены в таблице 2.
Таблица 2
Количественное определение цефоперазона в моче методом капиллярного электрофореза («Капель-105»)
|
№ п\п |
Цефоперазона в 0,1 мл мочи, мкг |
Определено цефоперазона |
Метрологические характеристики |
|
|
мкг |
% |
|||
|
1. |
20,0 |
14,70 |
73,50 |
S = 3,28 СV% = 4,43
S
ε% = 5,51 |
|
2. |
20,0 |
14,20 |
71,00 |
|
|
3. |
20,0 |
15,50 |
77,50 |
|
|
4. |
Контрольный опыт |
- |
- |
|
|
5. |
10,0 |
5,68 |
56,80 |
S = 2,25 СV% = 3,92
S
ε% = 4,87 |
|
6. |
10,0 |
5,98 |
59,80 |
|
|
7. |
10,0 |
5,54 |
55,40 |
|
|
8. |
Контрольный опыт |
- |
- |
|
|
9. |
5,0 |
2,57 |
25,70 |
S = 1,27 СV% = 4,97
S
ε% = 6,18 |
|
10. |
5,0 |
2,66 |
26,60 |
|
|
11. |
5,0 |
2,41 |
24,10 |
|
|
12. |
Контрольный опыт |
- |
- |
|
Результаты, представленные в таблице 2 показали, что количественное определение цефоперазона в модельных смесях мочи на трех уровнях концентрации, отражает удовлетворительную сходимость результатов в пределах рекомендуемой аналитической области. Рассчитанное стандартное отклонение среднего результата находится в пределах критерия приемлемости. При этом условия пробоподготовки биологической жидкости позволяют устранить влияние балластных веществ и эффективно осуществить УФ-спектрофотометрическую детекцию (рисунок 2).
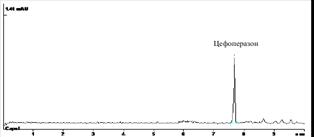

А Б

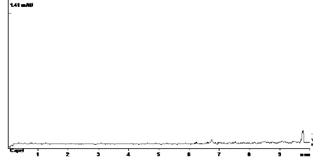
В Г
Рис.2.ЭФГ цефоперазона, выделенного из мочи при внесении 20 (А), 10 (Б), 5 (В) мкг вещества в 0,1 мл биожидкости; Г – ЭФГ после пробоподготовки контрольного образца мочи, 1 мл (blank); («Капель-105»)
Таким образом, разработанная методика на базе отечественной электрофоретической системы («Капель – 105») применима для количественного определения цефоперазона в моче, и может быть рекомендована для проведения анализа в химико-токсикологических лабораториях.
Выводы:
1. Разработана экспрессная методика определения цефоперазон в моче (объем пробы – 0,1 мл) на основе прямой экстракции органической системы (хлороформ – изобутанол в соотношении 3:1) с последующей реэкстракцией вещества в рабочий электролит, разбавленный водой, и электрофоретического исследования на приборе «Капель-105».
2. Показано, что по разработанной методике пробоподготовки, балластные вещества мочи не мешают фотометрическому определению.
3. Проведена валидационная оценка методики определения цефоперазона в моче. При статистической обработке полученные результаты находятся в пределах критериев приемлемости.
Рецензенты:Гейн В.Л., д.х.н., профессор, заведующий кафедрой общей и органической химии ФОО ГБОУ ВПО «Пермская государственная фармацевтическая академия» Минздрава России, г. Пермь;
Ярыгина Т.И., д.фарм.н. профессор, профессор кафедры фармацевтической химии ФОО ГБОУ ВПО «Пермская государственная фармацевтическая академия» МЗ РФ, г. Пермь.



