Как же изменились взгляд на проблему развития рака яичников в последние годы? Еще в 1971 году была предложена теория происхождения большинства раков яичника из клеток поверхностного эпителия яичников и инклюзионных кист [14]. Несмотря на ограниченное количество и уязвимость доказательств такого объяснения патогенеза данной патологии, оно долгое время поддерживалось учеными, поскольку в отсутствии накопленных знаний о молекулярно-биологической и генетической природе различных вариантов рака яичников, выдвижение альтернативной теории было невозможно. Проведение же таких исследований позволило установить, что варианты рака яичников характеризуются различными механизмами развития и источниками происхождения, а роль поверхностного эпителия яичника совсем не так велика, как это предполагалось ранее[26].
Кроме того, изменилось представление о классификации рака яичников: на определенном этапе была сделана попытка объединить все типы раков в две большие группы (рак яичников I типа, куда вошли высокодифференцированные серозная, эндометриоидная, светлоклеточная и муцинозная карциномы и опухоли II типа, объединившие низкодифференцированную серозную и муцинозную карциномы, смешанную злокачественную мезодермальную опухоль и недифференцированную карциному). Данное объединение было сделано преимущественно на основании злокачественного потенциала опухолей I и II типов, однако не все специалисты поддерживают такую унификацию – во-первых, каждый из подвидов, вошедших в ту или другую группу, характеризуется разными гистологическими, генетическими и молекулярно-биологическими характеристиками(рис. 1.).Во-вторых, разные варианты опухолей из одной группы по-разному отвечают на химиотерапевтическое лечение и имеют разный прогноз выживаемости пациенток[42].

Рис. 1. Наиболее часто встречающиеся мутации, характерные
для различных вариантов карцином яичника
(адаптировано по Crum [42],Shih и Davidson[54], StewartC.J и соавт. [57])
В связи с этим, а также в виду различных предполагаемых источников происхождения, мы рассмотрим каждый из вариантов рака яичников в отдельности. Кроме того, отдельного внимания заслуживают и те нарушения регуляции сигнальных путей, которые имеют место при развитии того или иного варианты, поскольку именно эти события играют ключевую роль в их патогенезе.
1. Серозные карциномы.
Из всех типов рака яичников наибольший интерес представляют серозные карциномы – в научном плане в связи с революцией представлений о происхождении данного гистологического типа, в клиническом – в связи с наибольшей частотой возникновения.Среди серозных раков в настоящее время выделяют два основных типа – высокодифференцированная серозная карцинома яичника и низкодифференцированная серозная карцинома яичника. Помимо различных гистологической и молекулярно-генетической характеристик эти два варианта, как полагают, имеют и различные источники происхождения, и различный патогенез.
1.1.Низкодифференцированная серозная карцинома яичника (НСКЯ).
НСКЯвстречается примерно в 70% от всех карцином яичников[26]. Приблизительно в 95% случаев при НСКЯ выявляются мутации TP53[50]. Наследственные формы НСКЯ также характеризуются мутациями BRCA 1 и BRCA2, и, хотя последние не характерны для спорадических НСЯК, инактивация данных генов в этих опухолях за счет других механизмов (например, метилирования) наблюдается почти в половине случаев[7, 34].Помимовысокойиммунореактивностивотношенииp53, приНСКЯвыявляетсявысокийуровеньэкспрессииKi-67 ир16 [9].ТакжеприНСКЯ наблюдаетсяядернаяэкспрессияWT1 (чтотакжехарактерноидлявысокодифференцированных серозных карцином яичников (ВСКЯ),нонеприсущедругимвариантам) [4,35,42]. В 2/3 случаев при НСКЯ экспрессируютсяэстрогеновые рецепторы, что также может выявляться при ВСКЯ и эндометриоидных карциномах, но не характерно для светлоклеточных и муцинозных карцином яичника[6,21]. Долгое время основными источниками развития серозных карцином считался поверхностный эпителий яичников, а также органы, принадлежащие к так называемой вторичной мюллеровой системе. И, хотя эта теория объясняла возникновение опухолей, аналогичных по строению серозных опухолям яичника, за его пределами, подтверждение трансформации мезотелия брюшины или поверхностного эпителия яичников (прямой или путем метаплазии) в эпителий, имеющий мюллеров фенотип получить по-прежнему, довольно трудно[31].В настоящее время основным источником развития НСКЯсчитается эпителий маточной трубы. Впервые такое предположение было сделано J.Piek и соавт.[40], описавшими у женщин, предрасположенных к раку яичников, предшественник НСКЯ – трубную серознуюинтраэпителиальную карциному (СТИК) в сочетании с инвазивной серозной карциномой маточной трубы, имеющей значительное сходство с НСКЯ. При этом изменений яичников у данных женщин обнаружено не было. Кроме того, патологические изменения были выявлены в основном в фимбриальном конце маточной трубы и крайне редко выявлялись в других ее отделах, что позднее было подтверждено и другими авторами[12,34]. Полученные в данной работе результаты послужили толчком к пересмотру алгоритма исследования маточной трубы, поскольку было сделано предположение о гиподиагностике предраковых поражений и интраэпителиальных раков маточной трубы. Был разработан протокол исследования маточной трубы, направленный на подробное изучение ее структуры, главным образом – фимбриального отдела (протокол, регламентирующий вырезку и подробное исследование фимбриального отдела маточной трубы (SEE-FIMprotocol) [37].Дополнительные исследования, проведенные с использованием такого протокола выявили, что СТИК и ранние инвазивные карциномы маточной трубы появляются не только у женщин с генетической предрасположенностью развития рака яичников (BRCA 1,2- позитивных), но и у 50-60% женщин без мутации BRCA[20,34].Кроме того, были обнаружены идентичные мутации ТР53 в СТИК и сопутствующей НСКЯ, что свидетельствует о клональных взаимосвязях между данными поражениями[29].Также были проведены иммуногистохимические исследования НСКЯ, в результате которых выявлено, что данный тип опухоли PAX 8-позитивен и calretinin – негативен, что характерно для эпителия маточной трубы, имеющего происхождения из мюллерова эпителия, и не характерно для поверхностного эпителия яичника, имеющего мезотелиальное происхождение[27].Все эти данные свидетельствуют в пользу того, что именно СТИК является прямым предшественников НСКЯ.
Что касается самых ранних этапов патогенеза НСКЯ, которые затрагивают трансформацию нормального эпителия маточной трубы в СТИК, то этот процесс, как полагают, также носит ступенчатый характер. В настоящее время в качестве предшественников СТИК выделяют такие поражения, как «р53-signature» и трубное серозное интраэпителияльное поражение (СТИП) [16,27].В качестве «р53-signature» рассматриваются участки эпителия маточной трубы, включающие не менее 12 последовательно расположенных секреторных клеток и имеющие высокую экспрессию р53 и низкий пролиферативный индекс (низкая экспрессия ki-67) в отсутствии гистологических изменений эпителия [42]. Также в этих участках отмечается положительная экспрессия gamma-H2AX,свидетельствующая о нарушениях репарации ДНК [27].СТИП характеризуется средней степенью атипии ядер эпителия маточной трубы (но менее выраженной, чем при СТИК), низким уровнем экспрессии Ki-67 и высокой экспрессией р53[16]. Таким образом, предшественники СТИК имеют общие генетические нарушения, касающиеся в первую очередь мутаций р53 и BRCA, причем считают, что мутация р53 является более ранним событием в патогенезе СТИК, чем мутация BRCA[27].Кроме того, для каждой из данных патологий был разработан не только ряд гистологических критериев, но и иммуногистохимическая характеристика, что, возможно, позволит патологам более точно верифицировать патологический процесс в маточной трубе.
Однако, принимая во внимание всю убедительность рассмотрения СТИК в качестве предшественника НСКЯ, даже при подробном исследовании маточных труб женщин с НСКЯ или первичной серозной карциномой брюшины поражение в них выявляется лишь в 50-60% [43]. Это может объясняться техническими недочетами (недостаточным количеством срезов с парафиновых блоков и гиподиагностикой СТИК), тем, что карцинома «поглотила» СТИК в процессе роста, а также наличием еще одного источника развития НСКЯ – инклюзионных кист[26]. Ранее считалось, что единственным источником происхождения инклюзионных кист является поверхностный эпителий яичника, который участвует в их образовании, формируя инвагинации в корковый слой яичника. Однако в настоящее время установлено, что существует еще один тип инклюзионных кист, эпителий которых имеет сходство с эпителием маточной трубы и экспрессирует маркеры, характерные для последнего.
Скорее всего, данный тип инклюзионных кист формируется при имплантации эпителия маточной трубы на поверхность яичника, и в таких кистах могут протекать все последовательные этапы патогенеза СТИК. Соответственно, при отсутствии СТИК у женщин с НСКЯ или первичной серозной кацриномой брюшины, можно предположить, что инициация данного процесса произошла не на территории маточной трубы, а уже на территории яичника (в инклюзионной кисте), хотя предшественником патологического процесса в данном случае все равно выступит эпителий маточной трубы [41].
. Нельзя не отметить и тот факт, что ряд НСК, как полагают некоторые исследователи, развивается из ВСК, однако механизм данной трансформации до конца не изучен (рис. 2). Полностью нельзя и исключить происхождение НСКЯ из поверхностного эпителия яичника, особенно в области трубно-яичниковых и трубно-перитонеальных переходных зоны.
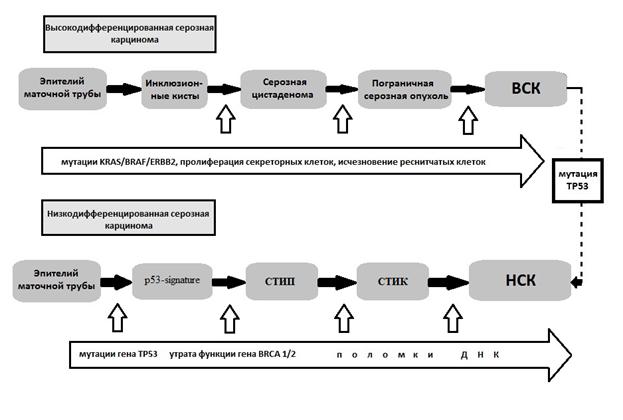
Рис. 2. Патогенез низко-и высокодифференцированных карцином яичника
(адаптирован по R.Kurman иJ. Li [29])
1.2.Высокодифференцированная серозная карциномаяичника (ВСКЯ)
ВСКЯ составляет менее 5% всех карцином яичника. Современные представления о патогенезе ВСКЯ заключаются в последовательной трансформации эпителия инклюзионных кист с мюллеровым фенотипом в серозные цистаденомы, серозных цистаденом– в серозные пограничные опухоли, последних – в неинвазивные ВСКЯ с дальнейшим развитием ВСКЯ.Было показано, что основным сигнальным путем, в котором происходят нарушения при ВСКЯ и ее предшественниках, является MAPK (компонентами которого являются BRAF, KRAS, ERBB2 (кодирующий HER2/neu). Так, мутации BRAF обнаруживаются в 8% ВСК, а KRAS – в 19%.При этом тщательное изучение мутаций компонентов этого сигнального пути также вносит вклад в доказательство стадийности патогенеза ВСКЯ. Было показано, что мутации KRAS и BRAF не выявляются в серозных цистаденомах, но присутствуют в пограничных опухолях, и, таким образом, могут явиться ранними событиями развития ВСКЯ. Также была выявлено более интенсивная экспрессия генов сигнального пути MAPK в неинвазивных ВСКЯ по сравнению с пограничными опухолями, кроме того, молекулярная характеристика неинвазивных ВСКЯ ближе к ВСКЯ, чем к пограничным опухолям [33,42].
Нельзя также не упомянуть о том, что по некоторым данным источником ВСКЯ может стать имплантация фрагментов маточной трубы при развитии в ней папиллярной гиперплазии[25], характеризующейся наличием мелких папиллярных скоплений клеток эпителия маточной трубы без атипии (как секреторных так и реснитчатых), что часто ассоциировано с псаммомными тельцами. Известно, что такие участки могут выявляться в маточных трубах у большинства женщин с пограничными серозными опухолями яичников, распространяться по трубе и имплантироваться на яичник (инициируя развитие пограничной опухоли) или тазовые органы (являясь причиной неинвазивныех имплантатов)[26].
2. Муцинозные опухоли
Муцинозные опухоли составляют около 3% от всех карцином яичника[42]. Имея специфический фенотип, отличный от других типов карцином яичника, муцинозные карциномы иммунореактивны в отношении CDX2 и KRAS, что соответствует дифференцировки эпителии этих опухолей по кишечному типу (который имеет место в большинстве случаев)[15].В отличие от метастатических опухолей, первичные муцинозные карциномы дают резко положительное окрашивание в отношениицитокретаина 7, в то время как экспрессия CDX2 и KRAS выражена слабо.Кроме того, для дифференциальной диагностики первичных муцинозных карцином рекомендуется использовать маркеры эстрогеновых рецепторов и WT1, в отношении которых они негативны в отличие от эндометриоидных (дают положительное окрашивание на эстрогеновыйрцептор) и серозных (положительны в отношении обоих маркеров) карцином[3,4].
Источником муцинозных опухолей ранее также считался поверхностный эпителий яичника, однако в настоящее время полагают, что большинство (>95%) муцинозных карцином являются вторичными, происходящими, в основном из опухолей различных областей желудочно-кишечного тракта [48].
Происхождение же истинных первичных муцинозныхкарцином яичникаостается до конца не известным. По всей видимости, источник данного типа опухолей, представленных клетками обладающими немюллеровым фенотипом, в значительной степени отличается от источников других варрантов карциномы яичника. Поскольку участки доброкачественной и пограничной муцинозной опухоли часто сочетается с муцинозной карциномой, полагают, что патогенез данного варианта карциномы яичника представляет собой процесс последовательного перехода от доброкачественного фенотипа к пограничному и далее к злокачественному. В пользу данного утверждения говорит и тот факт, что аналогичные мутации в гене KRAS были выявлены в сочетающихся доброкачественных и пограничных муцинозных опухолях, а также в муцинозных карциномах[15.42]. Маловероятно, что муцинозные опухоли исходят из инклюзионных кист коркового слоя яичника, поскольку муцинозная метаплазия эпителия в инклюзионных кистах встречается крайне редко [26]. Отельные авторы полагают, что источником муцинозных карцином могут служить клетки узелков Вальтхарда, с которым они часто ассоциированы и, возможно, имеют общий гистогенез. Кроме того, было выявлено, что при тщательном изучении муцинозныхцистаденом, в части из них обнаруживаются фокусы опухоли Бреннера, которые, как известно, имеют переходноклеточный фенотип[49]. Были получены данные, в соответствии с которыми муцинозные карциномы могут иметь происхождения из клеток эпителия маточных труб [28]. Некоторые авторы также полагают, что муцинозные опухоли могут иметь происхождение из очагов эндометриоза, другиежеопровергаютэтоутверждение[40].
Принимая во внимание существование сразу нескольких гипотез возникновения муцинозных карцином, в чем-то дополняющих, а в чем-то и противоречащих друг другу, можно заключить, что для истинный источник этих опухолей пока не установлен, и для
этого необходимо проведение дополнительных исследований.
3. Эндометриоидныеи светлоклеточные карциномы
Эндометриоидные и светлоклеточные карциномы составляют примерно 20% случаев карцином яичника (по 10% соответственно)[5,42]. Эти варианты карциномы яичника существенно отличаются от серозных и муцинозных карцином набором характерных для них генетических нарушений. Наиболее часто встречающейся мутацией при светлоклеточных карциномах является инактивирующая соматическая мутация ARID1A), (компонент комплекса SNF-A, который, как известно, может усиливать или угнетать транскрипцию) (возникаетпримернов 50% случаев) [18,30].ТакжевэтихопухоляхнаблюдаетсяактивирующаямутацияPIK3CA(28-50% случаев[11,44], делециягенаPTEN (регуляторPI3K/Akt-сигнальногопути (примернов 20% )[47]. Кроме того, в светлоклеточных карциномах яичника была выявлена частая амплификация локуса ZNF217 (белок-цинковый палец 217)[13,45], который, в частности регулирует сигнальный путь TGF-бета, и делеция локуса CDKN2A/2B (мутации на участке CDKN2A проявляются в снижении эффективности механизмов подавления опухоли p53 и RB)[47]. В связи с этим оба этих сигнальных пути, как предполагают, являются одними из основных в развитии эндометриоидных и светлоклеточных карцином[26].
ВнизкодифференцированныхэндометриоидныхкарциномахтакжевыявляютсямутациисигнальногопутиPI3K/Akt, причеммутацииPTEN, редкодиагностируемыепридругихвариантахкарциномяичников, встречаютсяприэндометриоидныхкарциномахпримернов 20% [36].Такжепримерно в 40% случаевэндометриоидныхкарциномбыливыявленынарушенияврегуляцииWnt/β-cateninсигнальногопути (восновномзасчетмутацииCTNNB1, гена, кодирующегоβ-catenin) [39]. Некоторые исследователи отмечают, что мутации PI3K/Akt и Wnt/β-catenin более характерны для высокодифференцированных эндометриоидных карцином, в то время как низкодифференцированнымэндометриоидным карциномам присуще наличие мутации р53[8,11,3378]. Однако в некоторых низкодифференцированных эндометриоидных карциномах могут присутствовать как мутации PI3K/Akt и Wnt/β-catenin, так и р53, что свидетельствует о возможности в редких случаях перехода высокодифференцированныхэндометриоидных карцином в низкодифференцированные (что можно сказать и о серозных карциномах).Мутации компонентов MAPK-сигнального пути также изучались в эндометриоидных карциномах, в одной из последних работ приводятся данные относительно частоты мутации KRAS (29%), причем авторы отмечают, что данная мутация характерна именно для эндометриоидных карцином, имеющих происхождение из очагов эндометриоза.Чтожекасаетсяразличийвмолекулярно-генетической основе патогенезаэндометриоидныхисветлоклеточныхкарцином, тобылоотмечено, чтополомкиWnt-сигнальногопутиинестабильностьмикросателлитнойДНКхарактерныдляэндометриоидныхкарцином, норедкообнаруживаютсявсветлоклеточныхкарциномах[5,32], в то время как для светлоклеточных карцином характерно наличие значительно более длинных теломер по сравнению с другими вариантами карцином яичника[24].
В настоящее время основной гипотезой о происхождении эндометриоидных и светлоклеточных карцином яичника является предположении об их возникновении из очагов эндометриоза и эндометриоидных кист [26,42].
Точный источник развития самого эндометриоза до сих пор не известен. Возможно, он развивается insitu путем метаплазии мезотелиального эпителия брюшины или поверхностного эпителия яичника[22].Вторым вероятным путем развития эндометриоза является имплантация ретроградно распространяющегося во время менструации эндометрия[10].Нужно заметить, что экспериментально подтвердить метапластическую теорию довольно трудно, в то время как накоплено немало доказательств имплантационной теории: в частности, было выявлено, что в эутопическом эндометрии у женщин с эндометриозом обнаруживаются врожденные молекулярные аномалии, включая активацию онкогенных сигнальных путей[18].Предполагают, что эти изменения дают возможность имплантироваться, выжить и проникнуть в ткань яичника или брюшины такому эндометрию. Кроме того, были выявлены поломки в одних и тех же локусах хромосом в карциномах и прилежащих участках эндометриоза, что говорит о клональности данного патологического процесса[17].Также эндометриоидные карциномы часто сочетаются с эндометриоинымиимплантами в других отделах таза.Теория, в соответствии с которой эндометриоидные и светлоклеточные опухоли развиваются из эндометрия, имплантировавшегося в яичник, подтверждаются также эпидемиологичеcкими исследованиями, показывающими, что перевязка маточных труб снижает возможность развития только эндометриоидных и светлоклеточных карцином, предотвращая ретроградный пассаж менструальной крови, но не влияет на развитие серозных карцином, которые, как было описано выше, скорее всего имеют происхождение из эпителия маточных труб [46].
Заключение
В последнее десятилетие представление о патогенезе карцином яичника существенно изменилось, молекулярно-генетические особенности и источники возникновения различных вариантов карциномы стали не менее важными принципами их классификации, чем гистологическая характеристика. В частности, серозные карциномы, степень дифференцировки которых ранее определялась в основном на основании морфологических критериев, в настоящее время делятся на высоко-и низкодифференцированные серозные карциномы, которые представляют собой практически две разные опухоли, имеющие, как полагают, различный патогенез и характеризующиеся различным набором мутаций.
Одним из наиболее революционных моментов в изучении патогенез карцином яичника явилось предположение о том, что большинство этих опухолей имеет вторичное происхождение. Так, основным источником серозных карцином в настоящее время считается эпителия маточных труб, муцинозных – опухоли различных областей желудочно-кишечного тракта и в небольшом количестве случаев – узелкиВальтхарда, эндометриоидных и светлоклеточных – очаги эндометриоза, который в свою очередь, наиболее вероятно имеет имплантационный патогенез и происходит из модифицированного эндометрия. Таким образом, господствующий в прошлом взгляд на поверхностный эпителий яичника как на главный источник развития карцином яичника кардинальным образом изменился, теперь к истинно первичным опухолям яичника ученые склонны относить лишь стромальные и зародышевоклеточные опухоли. Это обстоятельство, естественно, существенным образом должно повлиять и на лечебную тактику. В частности, выполнение сальпингоэктомии с сохранением яичников у женщин с высоким риском развития рака яичников, возможно, даст положительные результаты и поможет избежать негативных последствий аднэксэктомии.
Так или иначе, немалое количество вопросов, касающихся патогенеза рака яичников, остается без ответа. Роль поверхностного эпителия яичников, которой в настоящее время не отводится большого места, все же до конца не выяснена, в частности, не определено место эпителиально-мезенхимального перехода в патогенезе рака яичников. Не мало исследований в настоящее время посвящены и стволовым клеткам яичника, как нормальным, так и раковым. Существования их уже доказано, но каким образом они влияют на развитие опухоли во многом еще предстоит выяснить. Таким образом, можно сказать, что совсем недавно начата новая глава в истории изучения патогенеза карцином яичника и в этой главе еще очень многое предстоит описать.
Рецензенты:Щеголев А.И., д.м.н., профессор, заведующий патологоанатомическим отделением ФГБУ «НЦАГиПим.В.И. Кулакова» Минздрава России, г. Москва;
Козаченко А.В., д.м.н., ведущий научный сотрудник гинекологического отделения ФГБУ «НЦАГиПим.В.И. Кулакова» Минздрава России, г. Москва.



