Ахондроплазия – системное поражение скелета, в основе которого лежат генетические изменения, приводящие к нарушениям энхондрального роста длинных и коротких трубчатых костей. Заболевание относится к группе физарных дисплазий.
Известно, что ахондроплазия – заболевание, требующее хирургической коррекции, является следствием генной мутации в одной из хромосом 4-й пары в локусе, соответствующем кодированию аминокислотной последовательности полипептидной цепи тирозинкиназы, являющейся трансмембранным рецептором фактора роста фибробластов 3. При этой патологии наблюдаются дефекты во взаимодействии на оси соматотропный гормон – соматомедины, а также низкая активность факторов эритропоэза. Отклонения физического развития детей с ахондроплазией обусловлены как генной мутацией, так и образом жизни и социальным статусом. Непропорциональное развитие тела и низкий рост порождает целый ряд проблем, решить которые можно, прибегнув к устранению нарушения длины и формы конечностей методом чрескостного дистракционного остеосинтеза.
К началу 80-х гг. прошлого века задача увеличения роста оперативным путем у больных с врожденным системным недоразвитием осевого скелета была решена посредством применения полилокального полисегментарного чрескостного дистракционного остеосинтеза. К настоящему времени актуальной остается проблема выявления критериев продолжительности и интенсивности хирургической коррекции и разработки новых, надежных методов лабораторного мониторинга течения репаративного процесса, а также связанных с ним изменениях, происходящих в организме на фоне хирургического вмешательства [4].
Существует множество способов оценки течения репаративного процесса, в основе которых лежит определение активности костных рострегулирующих факторов. Одним из них является биотестирование сыворотки крови, предложенное Ю.П. Балдиным и К.С. Десятниченко. Известно, что ряд фракций неколлагеновых белков костной ткани оказывают влияние на остеогенез и гемопоэз. Следовательно, оценивая характер влияния компонентов сыворотки на состав периферической крови, можно сделать заключение о состоянии регенераторного потенциала организма [5].
Феномен изменения клеточного пейзажа периферической крови вследствие костной травмы, а также факт наличия общих предшественников у форменных элементов крови и остеогенных клеток позволяет констатировать существующую взаимосвязь гемопоэза и остеогенеза [2,7]. Регуляция остеогенеза и гемопоэза в организме осуществляется как на системном, так и на местном уровне, в котором принимают участие цитокины и факторы роста различной природы. Исследования ряда последних лет показали, что их присутствие в циркуляторном русле обуславливает остеогенный эффект сыворотки крови пациентов с активным остеогенезом [1]. Причем, повреждение опорно-двигательного аппарата при оперативных вмешательствах и костных травмах является основным условием их интенсивного поступления в циркуляторное русло. Таким образом, активность факторов остеогенеза отражает состояние репаративного процесса в организме.
Различные методики биотестирования сыворотки крови применяются в практическом здравоохранении [3], однако работы, посвященные данному вопросу в области ортопедии, практически отсутствуют в научной литературе.
Цель исследования – изучить возможность использования результатов биотестирования сыворотки крови пациентов с ахондроплазией на различных этапах остеосинтеза для определения их регенераторного статуса.
Материалы и методы
Материалами биохимических исследований были сыворотка крови 52 больных ахондроплазией обоего пола в возрасте от 6 до 14 лет. Сыворотку крови получали за несколько дней до операции, в первые 3–5 дней послеоперационного периода, далее 1 раз в неделю с начала дистракции и 2 раза в неделю на этапе фиксации. Кроме этого, материал для исследований получали в отдаленные сроки после снятия аппарата Илизарова. Кровь для анализа получали венепункцией и собирали в гепаринизированные пробирки, сыворотку отделяли центрифугированием (ЦЛР-1, 3000 об/мин).
Выделение материала для биотестирования проводили следующим образом. Из 0,1 мл сыворотки крови больного выделяли компоненты, преципитирующие в диапазоне насыщения сульфата аммония >30-<50 %. Из преципитата выделяли фракции, сорбирующиеся на ДЭАЭ-целлюлозе. Полученные пробы подвергали диализу против дистиллированной воды и лиофильно высушивали. Полученный лиофилизат растворяли 0,04 мл физиологического раствора, которые подкожно вводили белым лабораторным мышам массой 24–26 грамм. Исследование количества форменных элементов крови мышей производили в камере Горяева. Подсчет лейкоцитарной формулы – из расчета на 100 клеток при окрашивании по Романовскому – Гимза. Подсчет количества ретикулоцитов на 1000 эритроцитов – на предметном стекле, окраска бриллиантовым крезиловым синим. Кровь у мышей отбирали из хвостовой вены. Исследования проводили до введения исследуемых фракций и через 48 часов после введения. Изменение содержания в периферической крови исследуемых клеток выражали в процентах от исходного уровня. Гематологические исследования проведены С.П. Изотовой.
Все манипуляции с экспериментальными животными были проведены в соответствии с отечественными и европейскими требованиями по обращению с экспериментальными животными. Математическая обработка результатов включала в себя вычисление медианы, 25 % и 75 % процентиля. Достоверность отличий в группах определяли, используя критерии Вилкоксона для связанных и несвязанных выборок.
Результаты исследований и их обсуждение
Для поддержания нормального процесса ремоделирования костной ткани необходимо наличие соответствующего костномозгового микроокружения. Синтезируемые стромальными клетками и поступающие гуморальным путем цитокины играют существенную роль в процессах костного ремоделирования. Они включают в себя интерлейкины, факторы некроза опухоли, колониестимулирующие факторы и др. Трансформирующий фактор роста b (ТФРb) играет важную роль при образовании, ремоделировании и репарации кости. Было обнаружено, что ТФРb способен ингибировать костную резорбцию, индуцируемую другими факторами, повышать активность щелочной фосфатазы. Однако в зависимости от условий культивирования и наличия других регуляторов роста ТФРb может играть роль ингибитора пролиферативных и биосинтетических процессов в тех же клетках, на которые он оказывал стимулирующий эффект.
Изменения гемопоэтической активности сыворотки крови имеет место сразу после оперативного вмешательства. Однако в первые дни после операции активация гемопоэза (по уровню ретикулоцитов) не столь значительна, как в период третьей и четвертой недели после начала дистракции, когда по сравнению с дооперационным уровнем увеличение содержания ретикулоцитов в периферической крови экспериментальных животных достигает 300 % и более (Рис. 1). В последующие периоды происходит плавное снижение способности модифицированных компонентов крови пациентов с ахондроплазией стимулировать изменения количества ретикулоцитов в периферической крови мышей. К концу периода фиксации значения приближаются к дооперационным.
Изменения содержания моноцитов в периферической крови мышей имели схожий характер (Рис. 2). Наибольшие изменения фиксировались на 3 и четвертой неделе дистракции. На более поздних сроках фиксации появляется тенденция к росту активности фракций, оказывающих влияние на активность пролиферации моноцитов.
Характерно подавление эритропоэза у мышей в ответ на введение модифицированных компонентов сыворотки крови больных ахондроплазией. Сразу после операции происходит достоверное изменение исследованных показателей гемопоэза. С началом дистракции в сыворотке крови начинают преобладать компоненты, активизирующие процессы эритропоэза. В сроки, следующие после 1 месяца дистракции, происходит снижение этих показателей. Способность компонентов крови, активированной остеогенезом оказывать влияние на гемопоэз, по всей видимости обусловлена наличием в ее составе повышенного уровня различных цитокинов и факторов роста.
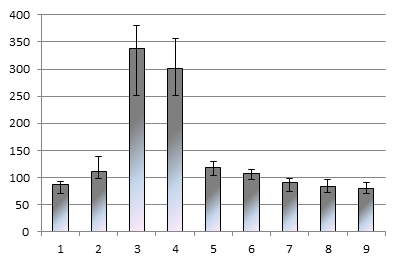
Рис.1. Изменение активации гемопоэза на этапах удлинения конечностей методом чрескостного дистракционного остеосинтеза по уровню ретикулоцитов на оси абсцисс – отмечены сроки лечения: (1 – до операции (n=18), 2 – 5 дней после операции (n=15), 3 – неделя дистракции (n=15), 4 – 1 месяц дистракции (n=17), 5 – 2 месяца дистракции (n=19), 6 – более 3 месяцев дистракции (n=14), 7 – 1 месяц фиксации (n=16), 8 – 3 месяца фиксации (n=12), 9 – после снятия аппарата (n=10))
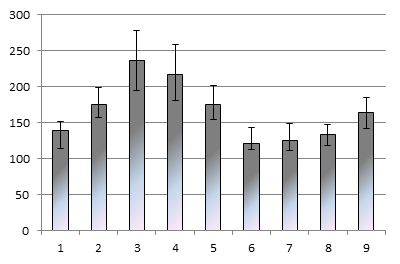
Рис.2. Изменение содержания моноцитов в периферической крови мышей, в ответ на введение компонентов сыворотки больных с ахондроплазией, на этапах удлинения конечностей методом чрескостного остеосинтеза на оси абсцисс – отмечены сроки лечения: (1 – до операции (n=18), 2 – 5 дней после операции (n=15), 3 – неделя дистракции (n=15), 4 – 1 месяц дистракции (n=17), 5 – 2 месяца дистракции (n=19), 6 – более 3 месяцев дистракции (n=14), 7 – 1 месяц фиксации (n=16), 8 – 3 месяца фиксации (n=12), 9 – после снятия аппарата (n=10))
Компоненты сыворотки крови больных ахондроплазией, выделенные по предлагаемой методике, подавляют эритропоэз у мышей. Сразу после операции происходит достоверное увеличение показателей гемопоэза, что говорит об активизации процессов ремоделирования в системе костной ткани.
С началом дистракции в сыворотке крови начинают преобладать компоненты, активизирующие процессы эритропоэза. В сроки, следующие после 1 месяца дистракции, происходит снижение этих показателей. На более поздних сроках фиксации появляется тенденция к росту активности фракций, оказывающих влияние на активность пролиферации моноцитов, что может быть связано с активацией процессов ремоделирования новообразованной костной ткани. Полученные результаты иллюстрируют течение репаративного остеогенеза при ЧДО и согласуются с клиническими данными [6].
Продолжение исследований в этом направлении позволило бы сформировать группы ортопедических больных с различным характером течения репаративного процесса и на основе этого разработать критерии оценки регенераторного статуса пациентов.
Выводы
1. Внутрибрюшинное введение модифицированных компонентов сыворотки крови пациентов с ахондроплазией приводит к угнетению эритропоэза у мышей.
2. Модифицированные компоненты сыворотки крови пациентов с ахондроплазией, взятые в период 3 и 4 недели дистракции, вызывают значительную активацию гемопоэза при внутрибрюшинном введении лабораторным мышам.
3. Предложенный способ биотестирования сыворотки крови пациентов ортопедического профиля, находящихся на этапах лечения методами чрескостного остеосинтеза, может быть использован в составе комплексной оценки протекания процесса костной регенерации.
Рецензенты:
Матвеева Е.Л., д.б.н., ведущий научный сотрудник, ФГБУ «РНЦ «ВТО» имени академика Г. А. Илизарова» Минздрава России, г. Курган;
Стогов М.В., д.б.н., ведущий научный сотрудник, ФГБУ «РНЦ «ВТО» имени академика Г. А. Илизарова» Минздрава России, г. Курган.



