Каким бы многообразием подходов не отличались современные эндодонтические методики, конечная их цель остается неизменной – качественная санация и надежная обтурация корневого канала для блокирования распространения инфекции в окружающие периапикальные ткани [2, 3, 7, 15].
Для обтурации корневых каналов используется множество пломбировочных материалов, существенно отличающихся между собой по химическому составу и свойствам [3, 5, 6, 9, 13]. Следует особо отметить тот факт, что проблеме реакции периапикальных тканей, слизистой оболочки верхнечелюстного синуса и тканей сосудисто-нервного пучка нижней челюсти на различные пломбировочные материалы уделено достаточно много внимания со стороны различных исследователей как у нас в стране, так и за рубежом [1, 4, 8, 10, 11, 12, 14, 16]. В частности, в диссертационных исследованиях Ф.И. Шульман (2003), К.Э. Арутюнян (2005), С.В. Сирак (2006), Р.С. Закерьяев (2009) подробно исследованы реакции вышеназванных видов соединительной и нервной ткани при непосредственном контакте с корневыми герметиками, установлено их повреждающее и цитотоксическое воздействие на биологические ткани организма.
В этой связи мы сочли возможным не останавливаться подробно на собственном анализе уже хорошо изученных фактов, а сконцентрироваться на исследовании наиболее типичных тканевых реакций при контакте разработанной нами корневой пасты с биологическими тканями для обоснования их использования в клинике при деструктивных формах периодонтита.
Цель исследования: методом экспериментального моделирования изучить изменения, возникающие при контакте разработанного материала для пломбирования корневых каналов зубов с периапикальными тканями, слизистой оболочкой верхнечелюстного синуса и сосудисто-нервным пучком нижней челюсти.
Материал и методы. Проведено несколько серий экспериментальных исследований на 20 кроликах породы «Серый Великан». Эксперименты одобрены комитетом по этической экспертизе исследований Кубанского государственного медицинского университета (протокол № 33 от 30.01.2015). Животных из эксперимента выводили путем эвтаназии в соответствии с Директивой 2010/63/EU ЕВРОПЕЙСКОГО ПАРЛАМЕНТА И СОВЕТА ЕВРОПЕЙСКОГО СОЮЗА по охране животных с отбором проб тканей для гистологических исследований. Все животные разделены на 2 группы, основную (10 животных) и контрольную (10 животных), в зависимости от вида пломбировочного материала. В основной группе использовали разработанный материал для пломбирования корневых каналов зубов при лечении деструктивных форм периодонтита (МППК-3), который готовили extempore непосредственно перед использованием (заявка на патент №2014121528 (034779) от 20.05.2014). В контрольной группе применяли материал на основе окиси цинка и эвгенола («Эндометазон»), как наиболее часто используемое стоматологами средство для обтурации корневых каналов с хорошо изученными свойствами.
Оперативное вмешательство на животных проводилось следующим образом. Под общей анестезией препаратом «Золетил», разрешенным для официального применения в ветеринарии из расчета 10 мг/кг массы тела, формировали доступ к верхнечелюстному синусу и сосудисто-нервному пучку, после чего вводили исследуемый материал. С целью определения точной локализации пломбировочного материала проводилось рентгенологическое исследование (рис. 1).
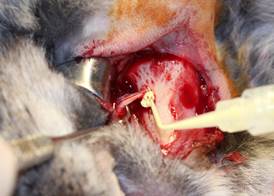
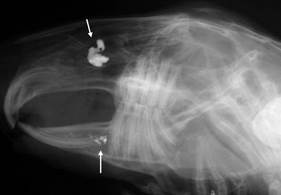
Рис. 1. Введение пломбировочного материала в нижнечелюстной канал кролика, справа – рентгенологический контроль в ходе операции на верхнечелюстном синусе и нижнечелюстном канале, стрелками отмечен пломбировочный материал
В послеоперационном периоде животные находились под наблюдением с акцентом внимания на характер заживления ран. В результате эксперимента получены и изучены 40 блоков верхней и нижней челюсти и 114 гистологических срезов.
Материал, взятый для гистологических исследований, фиксировали в 10 %-ном водном растворе нейтрального формалина, проводили через спирты возрастающей крепости и ксилол, а затем заливали в гистологическую среду «Гистомикс» с использованием станции парафиновой заливки TISSUE-tekTEC5 с температурой плавления 56–58 0С и гистологического процессора замкнутого типа Tissue-Tek VIP™ 5 Jr. c вакуумом производства ф. Sakura, Япония. Срезы толщиной 5 мкм готовили на ротационном микротоме Accu-Cut@SRMtm200, помещали на предметные стекла с матовым краем Menzel.
Для просмотра гистосрезов в микроскопе NiKonEclipse 80i их окрашивали гематоксилином и эозином, по Маллори, по Бильшовскому, по Футу, по Ван-Гизон, согласно рекомендациям, изложенным в руководстве В.В. Семченко с соавт. (2006). С каждого препарата выполняли цифровые снимки (в формате jpg, размером 3136×2352 пикселей в палитре 24 бит) при увеличении х10, х20, х40.
Результаты исследования
При инокуляции эндометазона в нижнечелюстной канал кролика отмечается выраженное острое альтеративное воспаление, что проявляется реакцией гиперчувствительности немедленного типа. Данный патологический процесс характеризуется нарушением реологических свойств крови – гиперемией, стазом, кровоизлиянием. Исследуемый материал («Эндометазон») обладает выраженным цитотоксическим действием, что характеризуется процессами тотальных некрозов не только чувствительных нервных волокон, а даже целых костных балок. Однако в исследуемых гистологических препаратах в срок 60 суток наряду с альтерацией наблюдаются процессы организации патологического процесса путем трансформации макрофагов в гигантские многоядерные клетки соединительной ткани (рис. 2).
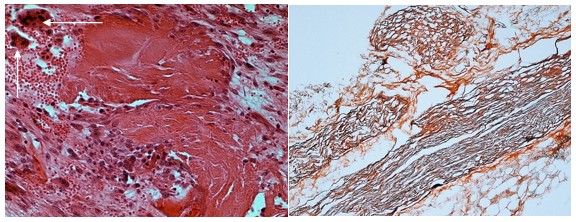
Рис. 2. Микропрепарат. Контрольная группа. Эндометазон. Слева. 30 сутки эксперимента. Тотальный некроз костной балки. Вверху слева (отмечено стрелками)- гигантские клетки. Внизу активные фибробласты. Окраска гематоксилином и эозином. Об. 40, ок. 10. Справа. 60 сутки эксперимента. Тотальный некроз нервного пучка. Окраска по Футу. Об. 10, ок. 10
Как показали результаты экспериментального исследования, на 30 сутки исследования гистопрепаратов с МПКК-3 в зонах контактного взаимодействия инокулированного материала и тканей организма визуализируются обширные некрозы опорно-трофических тканей – соединительной, которая просматривается в виде зернистой массы с клеточным детритом, костных трабекул, имеющих вид небольших гомогенных осколков. Вокруг зоны некроза образуется капсула, состоящая из молодой соединительной ткани, в которой основную клеточную массу представляют активные фибробласты. В капсуле визуализируются очаги, состоящие из лимфоцитарно-макрофагального инфильтрата, в котором единичные макрофаги содержат в цитоплазме частички материала. В периферической части капсулы просматривается наличие сосудов микроциркуляторного русла в состоянии стаза. Между капсулой и некротизированной тканью отмечается наличие эозинофильных лейкоцитов, расположенных в виде цепочки в один слой, некоторые из них проникают в зону некроза в тех местах, где лежат частицы материала (рис. 3А). Также просматриваются единичные участки периневрия и эндоневрия, в которые происходит выпот серозного транссудата между волокнами соединительной ткани, что характеризует данный процесс как серозный отек (рис. 3Б).
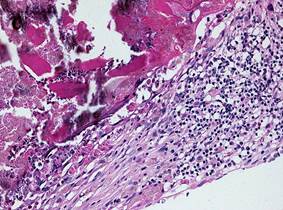 А
А  Б
Б
Рис. 3. Основная группа. МПКК-3. 30 сутки эксперимента. А)Микропрепарат. Зона некроза окруженная капсулой с лимфоцитарно-макрофагальным инфильтратом. Окраска гематоксилином и эозином. Об. 40, ок. 10. Б) Микропрепарат. Серозный транссудат между ретикулиновыми волокнами периневрия и эндоневрия. Окраска по Футу. Об. 20, ок. 10
На 60 сутки исследования в костных трабекулах просматривается выстраивание костной ткани по остеоидному типу строения. Недалеко от места формирования остеонов видны участки, в которых происходит врастание соединительной ткани и клеток фибробластического ряда из периоста в матрикс трабекул. В жировой ткани встречаются единичные клеточные элементы и инокулированный материал (рис. 4А). Периневрий местами подвергается фиброзу. В нем просматриваются частички материала, некоторые из которых фагоцитированы макрофагами, вокруг которых видны скопления эозинофильных лейкоцитов и сосудов в состоянии стаза. Повсеместно отмечаются участки, в которых имеет место наличие сформированных округлых лимфоцитарных гранулем. Скопления крупных конгломератов материала отмечается в периневрии. Вокруг них сформирована мощная соединительнотканная капсула, коллагеновые волокна которой отходят от капсулы и врастают в материал. Отмечается, что к стенке капсулы проходят артериолы, приносящие с кровью в капсулу трофические вещества (рис. 4Б).
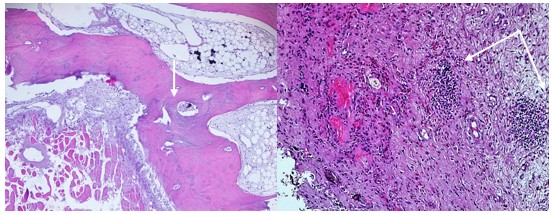
Рис. 4. Основная группа. МПКК-3. 60 сутки эксперимента. А)Микропрепарат. Формирование остеонов (центральная часть трабекулы) и врастание соединительной ткани вматрикс костной балки (нижняя расширенная часть балки). Окраска гематоксилином и эозином. Об. 10, ок. 10. Б) Микропрепарат. Лимфоцитарные гранулемы в периневрии (стрелки). Окраска гематоксилином и эозином. Об. 20, ок. 10
Таким образом, инокулированный в нижнечелюстной канал кролика стоматологический материал МПКК-3 вызывает слабовыраженное альтеративное воспаление, которое сменяется продуктивным процессом со стороны соединительной ткани и гранулематозным воспалением со стороны клеточных элементов, что проявляется формированием неспецифических лимфоцитарных гранулем и отражает типичный иммунный ответ организма на инородное тело. Данная реакция выражена незначительно, что дает основания полагать, что непродолжительный контакт пломбировочного материала, «случайно» выведенного в нижнечелюстной канал, с тканями сосудисто-нервного пучка нижней челюсти, не приведет к развитию некроза последнего. Данное предположение подтверждается в сроки наблюдения 60 суток, где отмечается отсутствие цитотокического эффекта МПКК-3.
Как показали результаты экспериментального исследования, разработанная паста для пломбирования корневых каналов при деструктивных формах периодонтита отличается от аналогов высокими противовоспалительными, рентгеноконтрастными и репаративными свойствами, позволяющими купировать воспаление в периодонте, стимулировать репаративные процессы в периапикальных тканях.
Рецензенты:
Каде А.Х., д.м.н., профессор, заведующий кафедрой общей и клинической патофизиологии ГБОУ ВПО КубГМУ Минздрава России, г. Краснодар;
Гайворонская Т.В., д.м.н., профессор, заведующий кафедрой хирургической стоматологии и челюстно-лицевой хирургии ГБОУ ВПО КубГМУ Минздрава России, г. Краснодар.



