Хроническая болезнь почек (ХБП) является одним из наиболее распространенных неинфекционных заболеваний. По данным American kidney fund ею страдают около 10% населения США [5]. При несвоевременной диагностике и лечении ХБП быстро прогрессирует, и на этом фоне развиваются различные осложнения, в частности артериальная гипертензия (АГ) и гипертрофия миокарда. ХБП и АГ тесно взаимосвязаны. С одной стороны, наличие заболеваний почек является одной из причин развития АГ, а с другой — высокое артериальное давление является ключевым патогенетическим фактором, способствующим снижению почечной функции [8].
Ранее нами было показано, что при ХБП у пациентов повышен не только нейрогенный тонус (НТ) сосудов микроциркуляторного русла (МЦР), но и его миогенный (МТ) и эндотелийзависимый (ЭЗТ) компоненты [2]. Принято считать, что в основе повышения НТ микрососудов у пациентов с ХБП лежит активация ренин-ангиотензин-альдостероновой системы (РААС) как в отдельных структурах головного мозга, так и в крови. Стимуляция РААС в гипоталамусе и гипофизе в свою очередь активирует симпатическую нервную систему (СНС) [3]. Полагают, что активация СНС — одна из важных детерминант повышения АД при ХБП. На периферии ангиотензин II также способствует увеличению высвобождения норадреналина в симпатических терминалях и ингибирует его обратный захват [6].
Если механизм повышения нейрогенного тонуса сосудов при ХБП в большей или меньшей степени понятен, то причины увеличения миогенного тонуса микрососудов у больных ХБП не совсем ясны. Полагают, что одной из причин увеличения МТ при ХБП является ингибирование Na/K-АТФазы мембраны гладкомышечных клеток (ГМК) мелких артерий и артериол [6]. Снижение активности Na-K-насоса приводит к накоплению в цитоплазме миоцитов Na+, а впоследствии и Са2+, что сопровождается возрастанием их напряжения, повышением тонуса микрососудов, увеличением общего периферического сопротивления и подъемом АД. Однако следует отметить, что прямых данных о степени снижении активности Na-K-АТФазы ГМК микрососудов при ХБП недостаточно. В экспериментах на животных получены данные о том, что субтотальная нефрэктомия и развивающаяся на этом фоне АГ сопровождаются увеличением в плазме крови концентрации эндогенных кардиотонических стероидов (КС), представляющих собой эндогенные лиганды Na/K-АТФазы [3]. Среди циркулирующих в крови КС наиболее значимыми и изученными являются эндогенный оуабаин (ЭО) и маринобуфагенин (МБГ). Полагают, что ЭО и МБГ выступают в качестве физиологических регуляторов активности Na/K-АТФазы и участвуют в регуляции натрийуреза и сосудистого тонуса [4,6].
Данных о концентрации КС, вовлеченных в регуляторные процессы при ХПБ у человека, недостаточно, а имеющиеся зачастую противоречивы [7, 8]. Не полностью изучен механизм их действия на Na/K-АТФазу ГМК. Цель данного исследования состояла в определении уровня ЭО и МБГ в крови у пациентов с ХБП и механизмов их влияния на ГМК сосудов МЦР.
Материалы и методы исследования
Объектом исследования были пациенты отделения диализа клиники Северо-Западного государственного медицинского университета им. И.И. Мечникова: 36 пациентов получали лечение гемодиализом (ГД) и 23 находились на хроническом амбулаторном перитонеальном диализе (ПД). Кроме них, в исследование были включены 22 добровольца (контрольная группа), не имеющих патологии со стороны почек и сердечно-сосудистой системы. Протокол исследования был одобрен этическим комитетом и клиническим Советом СЗГМУ им. И.И. Мечникова. Гемодиализные пациенты проходили лечение 3 раза в неделю. Режим перитонеального диализа предусматривал 4 обмена в сутки. Клинические характеристики пациентов и контрольной группы представлены в таблице 1.
Таблица 1
Клинические характеристики пациентов с ХБП-5д и контрольной группы
|
Показатель |
Пациенты на ГД |
Пациенты на ПД |
Контрольная группа |
|
Количество (м/ж) |
36 (21/15) |
23 (8/14) |
22 (10/12) |
|
Возраст (лет) |
47,7±3,8 |
51,3±4,9 |
45,4±3,7 |
|
Вес (кг) |
67±3,1 |
69±3,6 |
73±3,4 |
|
САД (мм рт. ст.) |
131±5,2 |
129±4,4 |
126±3,2 |
|
ДАД (мм рт. ст.) |
81±3,6 |
79±3,9 |
77±3,7 |
Исследование кровотока в сосудах МЦР кожи подушечки второго пальца руки (на этом участке кожи представлены все виды регуляции сосудистого тонуса) проводили с помощью многофункционального лазерного диагностического комплекса ЛАКК-М (исполнение 2) (ЛАЗМА, Россия). У пациентов, получающих лечение ГД, измерение проводили на руке, на которой не было функционирующей артериовенозной фистулы. Кровоток в сосудах МЦР измеряли на протяжении 8 мин. Для обработки ЛДФ-грамм применяли прилагаемое к аппарату стандартное программное обеспечение версии 3.0.2.376, работающее в операционной системе Windows. Величину НТ, МТ и ЭЗТ микрососудов рассчитывали в соответствии с рекомендациями разработчиков диагностического комплекса [1]. При каждом обследовании у пациентов измеряли артериальное давление тонометром Omron SpotArmTM i-Q142 (Omron Healthcare Co., Япония).
После записи ЛДФ-граммы у каждого исследуемого забирали 10 мл венозной крови. Часть крови использовали для определения уровня ЭО и МБГ, другая часть предназначалась для определения активности Na/K-АТФазы эритроцитов. Концентрацию КС в плазме крови определяли методом конкурентного иммунофлуоресцентного анализа с применением антител к маринобуфагенину и оуабаину. Активность Na/K-АТФазы эритроцитов определяли спектрофотометрическим методом [9].
Статистический анализ
Обработку полученных результатов проводили с использованием среднего арифметического (М) и стандартного отклонения (±SD). Для оценки различий применяли t-критерий Стьюдента и (в случае необходимости) критерий Манна—Уитни. Различия считали статистически значимыми при р<0,05.
Результаты исследования и их обсуждение
Патогенез АГ при ХБП достаточно сложен, повышение артериального давления при этом обусловлено несколькими причинами, в том числе повышением общего периферического сопротивления, формирующегося под влиянием: 1) симпатической нервной системы, 2) вазоконстрикторов и вазодилататоров, продуцируемых эндотелием, и 3) миогенного механизма регуляции. МТ сосудов МЦР при ХБП, в отличие от их НТ и ЭЗТ, изучен недостаточно. В определенной степени это связано со сложностью методических приемов. Сравнительно недавно внедренный в клинику метод ЛДФ позволяет непосредственно измерять величину среднего потока крови в исследуемом объеме ткани (перфузию) и амплитуды колебаний микрокровотока с распределением их на несколько диапазонов (в том числе нейрогенный, эндотелийзависимый и миогенный). Последние в дальнейшем используются для расчета НТ, ЭЗТ и МТ сосудов МЦР.
При первичном анализе ЛДФ-грамм, полученных в процессе исследования, было установлено, что показатель микроциркуляции (ПМ), характеризующий перфузию в коже второго пальца руки у пациентов с ХБП, был меньше по сравнению с аналогичным показателем в контрольной группе (табл. 2). При этом были также показаны достоверные различия между величинами ПМ у пациентов, получающих лечение ГД, и пациентов, находящихся на лечении ПД. Проведенные в последующем расчеты позволили выявить различия в величинах НТ, МТ и ЭЗТ сосудов МЦР исследуемой области у пациентов с ХБП и здоровых добровольцев.
Таблица 2
Параметры микрокровотока в коже подушечки второго пальца руки у пациентов с ХБП, получающих лечение гемодиализом и перитонеальным диализом, и в контрольной группе
|
Показатель |
Пациенты на ГД |
Пациенты на ПД |
Контроль |
|
ПМ (пф. ед) |
15,8±1,86 |
17,2±1,94* |
21,2±2,03 |
|
δ (пф. ед) |
1,8±0,16 |
2,0±0,19* |
2,5 ±0,23 |
|
НТ (отн.ед) |
8,69±0,74 |
8,33±0,77 |
6,67±0,51 |
|
МТ (отн.ед) |
12,01±1,37 |
10,88±1,35* |
8,17±0,97 |
|
ЭЗТ (отн.ед) |
13,07±1,29 |
12,18±1,27* |
9,92±0,99 |
Результаты представлены в виде M±SD. Все показатели у пациентов с ХБП достоверно отличаются от соответствующих показателей в контрольной группе, p<0,05. * — показаны достоверные различия между показателями в двух группах пациентов, получающих лечение ГД и ПД, p<0,05.
При анализе тонуса микрососудов видно, что у пациентов с ХБП повышены все составляющие тонуса по сравнению с контролем, в том числе и МТ (у пациентов, получающих лечение ПД, прирост составил +33,1%, а у находящихся на лечении ГД — +47,0%). Из литературных данных известно, что одной из причин, приводящих к повышению тонуса мелких артерий и артериол при ХБП, является ингибирование Na/K-АТФазы на мембране ГМК. В миоцитах кровеносных сосудов представлены преимущественно α-1 и α-2 изоформы Na/K-АТФазы, обладающие высокой чувствительностью к КС [10]. Удобным объектом для исследования свойств α-1 изоформы Na/K-АТФазы являются эритроциты [9]. Мы провели оценку акстивности Na/K-АТФазы эритроцитов пациентов с ХБП и в контрольной группе. Активность Na/K-АТФазы эритроцитов пациентов с ХБП оказалась в 2 раза ниже по сравнению с контролем (рис. 1).
Поскольку имеются данные о том, что одной из причин угнетения насосной функции Na/K-АТФы у пациентов с ХБП является повышение содержания в крови эндогенных КС [5, 10], мы провели исследование содержания ЭО и МБГ в плазме крови пациентов с ХБП и в контрольной группе. Концентрация ЭО в плазме крови пациентов с ХБП составила от 0,278 до 0,493 (в среднем 0,302±0,0343) нМ/л, в то время как в плазме добровольцев диапазон колебаний концентрации ЭО был от 0,163 до 0,364 (в среднем 0,279±0,0302) нМ/л. Концентрация МБГ в плазме крови пациентов с ХБП составила от 0,612 до 4,193 (в среднем 1,247±0,131) нМ/л, а в контроле — от 0,194 до 0,681 (в среднем 0,343±0,0367) нМ/л . Таким образом, было показано, что концентрации ЭО в плазме крови в обеих группах практически не отличались, в то время как содержание МБГ в плазме крови пациентов с ХБП в 3,6 раза превышало таковую в контроле (рис. 2).
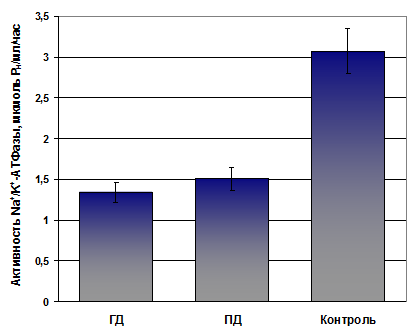
Рис. 1. Активность Na/K-АТФазы эритроцитов пациентов с ХБП, получающих лечение ГД и ПД, и в контрольной группе
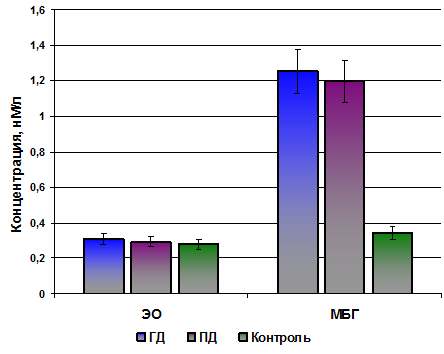
Рис. 2. Концентрация эндогенного оуабаина (ЭО) и маринобуфагенина (МБГ) в плазме крови пациентов с ХБП, находящихся на лечении ГД и ПД, и в контрольной группе
В последующем мы провели расчеты корреляционной связи между концентрацией МБГ в плазме крови и активностью Na/K-АТФазы эритроцитов. Связь оказалась отрицательной с коэффициентом корреляции 0,383. Затем была рассчитана корреляционная связь между концентрацией МБГ и диастолическим артериальным давлением (ДАД) у пациентов с ХБП. Связь между этими двумя показателями оказалась положительной с коэффициентом корреляции 0,648 (рис. 3).
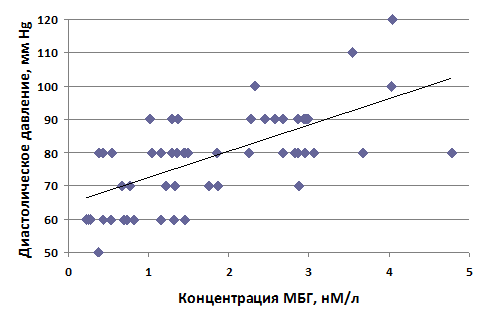
Рис. 3. Корреляция между уровнем МБГ в плазме крови и диастолическим артериальным давлением у пациентов с ХБП
На заключительном этапе мы сопоставили концентрации МБГ в плазме крови пациентов с ХБП и величины зарегистрированного у них МТ микрососудов. Между этими показателями была выявлена высокая положительная корреляционная связь с коэффициентом корреляции 0,746 (рис. 4).
Таким образом, в процессе исследования было показано, что у больных ХБП содержание МБГ в плазме крови было в 3,6 раза выше по сравнению с контрольной группой. Концентрация МБГ в плазме крови пациентов с ХБП коррелировала с величиной диастолического артериального давления у этих больных (средняя корреляция). Более того, была установлена сильная положительная корреляционная связь между концентрацией МБГ в плазме крови больных ХБП и величиной МТ микрососудов у них.
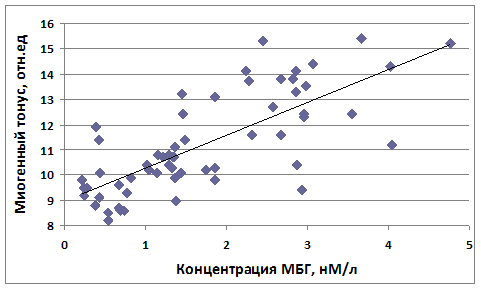
Рис. 4. Корреляция между уровнем МБГ в плазме крови и миогенным тонусом сосудов микроциркуляторного русла у пациентов с ХБП
Ранее in vitro было показано, что МБГ в концентрациях, сопоставимых с уровнем этого стероида в плазме крови in vivo, вызывает вазоконстрикторный эффект, а также ингибирование оуабаин-резистентной α1-Na/K–АТФ-азы в аорте [7]. Мы предположили, что у больных ХБП высокая концентрация МБГ в плазме крови может повышать миогенный тонус микрососудов и артериальное давление путем ингибирования транспортной функции α-1 Na/K–АТФ-азы в ГМК, что способствует входу Na+ внутрь клеток, деполяризации клеточной мембраны, стимуляции Na+/Ca2+ противообмена и активации сократительного аппарата миоцитов.
Однако корреляционная связь между уровнем МБГ в плазме крови и активностью Na/K-АТФазы оказалось слабой, что не позволяет объяснить повышение МТ микрососудов только ингибированием насосной функции Na/K-АТФазы. Ранее в экспериментах на животных было показано, что эндогенные КС наряду с ингибированием насосной функции Na/K-АТФазы и трансмембранного транспорта моновалентных катионов способны также активировать ее сигнальную (трансдукторную) функцию [4, 8]. Сигнальная функция опосредованного Na/K–АТФ-азой регуляторного каскада практически не зависит от ингибирования КС транспорта ионов, а запускается при связывании последних с Na/K–АТФ-азой в присутствии киназ семейства Src. Это приводит к активации рецепторов эпидермального фактора роста и фосфолипазы С с последующей активацией протеинкиназы С. На миокарде были получены прямые доказательства активации КС инициированного Na/K–АТФазой Src–EGFR–ERK-зависимого пути сигнализации [8].
Мы приходим к заключению, что высокая концентрация МБГ в плазме крови больных ХБП приводит не только к ингибированию насосной функции Na/K-АТФазы в ГМК сосудов, но и к активации в этих клетках трансдукторной функции опосредованного Na/K–АТФ-азой сигнального каскада. Результатом запущенной каскадной реакции являются активация протеинкиназы С, фосфорилирование ею киназы легкой цепи миозина и развитие сокращения ГМК, что приводит к вазоконстрикции, возрастанию МТ и повышению артериального давления. Полученные данные позволяют полагать, что второй механизм действия МБГ на ГМК сосудов является преобладающим.
Рецензенты:
Чурина С.К., д.м.н., профессор, заведующая лабораторией экспериментальной и клинической кардиологии Института физиологии им. И.П. Павлова РАН, г. Санкт-Петербург;
Пантелеев С.С., д.б.н., заведующий лабораторией кортико-висцеральной физиологии Института физиологии им. И.П. Павлова РАН, г. Санкт-Петербург.



