Эндогенная интоксикация является полиэтиологичным синдромом, развивающимся при заболеваниях различного профиля [1]. Особенностью эндогенной интоксикации является накопление в биологических жидкостях токсичных метаболитов, являющихся продуктами жизнедеятельности бактерий, в норме находящихся в организме, или образующихся в результате извращения гомеостаза [2, 4]. Печень и почки при эндогенной интоксикации поражаются в первую очередь, так как участвуют в элиминации избыточного количества токсичных веществ [3, 6]. Нарушение функции органов детоксикации и выделения утяжеляет эндоинтоксикацию и создает благоприятную почву для развития осложнений [5]. Сопутствующая эндотоксикозу тканевая гипоксия и блокада митохондриальных ферментов приводит к нарушению окислительного фосфорилирования и функциональным нарушениям на органном уровне [7]. Применение лазеротерапии представляется перспективным с патогенетической точки зрения, так как позволяет уменьшить выраженность эндогенной интоксикации и активизировать микроциркуляцию [8]. ![]()
Цель работы: исследовать эффекты низкоинтенсивного лазерного облучения крови на функциональную активность печени и почек при перитонеальном эндотоксикозе.
Материалы и методы исследования. Беспородным половозрелым собакам (n=44) моделировали острый экспериментальный перитонит по способу А.П. Власова (1991). Под тиопентал-натриевым наркозом в брюшную полость животных вводили шприцем 20% каловую взвесь (0,5 мл на 1 кг массы тела). Спустя 24 ч проводилась санация брюшной полости, применялась стандартная инфузионная и антибактериальная терапия (внутримышечные инъекции 2 раза в сутки раствора гентамицина из расчета 0,8 мг/кг массы тела; внутривенно 1 раз в сутки 5% раствор глюкозы и 0,89% раствор хлорида натрия из расчета 50 мл/кг).
Животных рандомизировали на две равные группы. На 1, 3, 5-е сутки фиксировали показатели, характеризующие выраженность эндоинтоксикации, функциональную способность почек и печени. В опытной группе животным в состав комплексного лечения также включали внутрисосудистое лазерное облучение крови двухканальным аппаратом лазерной терапии «Матрикс», использовались головка КЛ-ВЛОК (длина волны 635 нм), одноразовые стерильные световоды КИВЛ-1 с мощностью излучения на выходе 2 мВт, временем воздействия 15 мин.
Эксперименты выполнялись согласно этическим требованиям по работе с опытными животными («Правила проведения работ с использованием экспериментальных животных» (приказ МЗ СССР № 755 от 12.08.1987 г.) и Федеральный закон «О защите животных от жестокого обращения» от 01.01.1997 г.)). Все действия, приносящие животным боль, выполнялись под внутривенным наркозом (тиопентал-натрия из расчета 0,04 г/кг массы тела животного).
Методы исследования. Выполняли биохимические исследования (определение в крови мочевины, креатинина, остаточного азота, активности аланиновой трансаминазы (АлТ), аспарагиновой трансаминазы (АсТ), билирубина), скорости клубочковой фильтрации, канальцевой реабсорбции, минутного диуреза.
Определяли выраженность эндогенной интоксикации. Содержание молекул средней массы (МСМ) в сыворотке крови измеряли на спектрофотометре СФ-46 при длине волны 250 и 280 нм (Пикуза О.И., Шакирова Л.З., 1994). Для характеристики физико-химических свойств альбумина определяли эффективную и общую концентрацию альбумина в сыворотке крови флуоресцентным методом на специализированном анализаторе АКЛ-01 "Зонд". Рассчитывали резерв связывания альбумина, индекс токсичности плазмы (Грызунов Ю.А., Добрецов Г.Е., 1994).
Полученные цифровые экспериментальные данные обработаны методом вариационной статистики с использованием критерия t Стьюдента и χ2.
Результаты исследования и их обсуждение
Полученные данные подтвердили адекватность модели экспериментального перитонита. Зафиксировано существенное повышение уровней как гидрофильных, так и гидрофобных токсических субстанций в плазме крови, что свидетельствовало о формировании тяжелой эндогенной интоксикации. Уровень молекул средней массы при длинах волн регистрации 254 и 280 нм превышал норму на 76,5–136,1 % (р<0,05) и 57,0–141,0 % (р<0,05) соответственно. Также на 19,0–65,2 % (р<0,05) уменьшались общая и эффективная концентрация альбумина. Резерв связывания альбумина снижался на 19,0–49,4 % (р<0,05) параллельно с ростом индекса токсичности плазмы крови на 66,2–274,7 % (р<0,05) по сравнению с нормальными значениями исследуемых параметров.
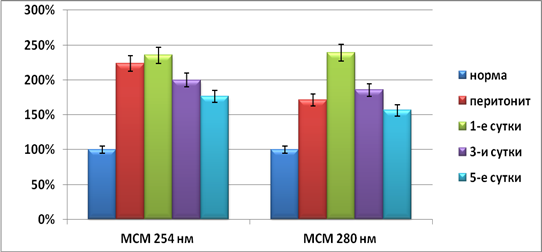
Рис. 1. Показатели, характеризующие эндогенную интоксикацию, в контрольной группе животных; *– достоверность данных по отношению к исходным значениям, р<0,05
Изучение функционального состояния печени на фоне эндогенной интоксикации перитонеального генеза выявило, что уровни трансаминаз повышались в течение всего динамического наблюдения. Показатели АсТ и АлТ превышали норму на 50,4–93,8 % (р<0,05) и на 95,1–132,9 % (р<0,05) соответственно. Уровень общего билирубина был выше исходного на 37,7–66,0 % (р<0,05).
Функциональное состояние почек при перитонеальном эндотоксикозе также изменялось. Зафиксировано повышение общего креатинина плазмы крови на 26,8–60,7 % (р<0,05) в течение всего наблюдения и креатинина мочи на 4,1 % (р<0,05) в первые сутки. Уровень мочевины и остаточного азота был на 13,4–31,9 % (р<0,05) и на 9,7–20,9 % (р<0,05) соответственно выше нормальных значений. Отмечалось уменьшение диуреза на 8,3–31,7 % (р<0,05), клубочковой фильтрации на 7,8–45,0 % (р<0,05), канальцевой реабсорбции на 10,0–32,8 % (р<0,05).
Вышеприведенные данные свидетельствуют о неспособности применяемой терапии эффективно корригировать нарушение функции органов элиминации – печени и почек – при эндогенной интоксикации.
Изучение функционального состояния печени на фоне применения лазеротерапии при остром перитоните выявило, что показатели АсТ были выше нормы на 6,2–46,9 % (р<0,05). По сравнению с контрольными значениями зафиксировано снижение показателя на первые, третьи и пятые сутки проводимого лечения на 24,2–29,4 % соответственно (р<0,05). Уровни АлТ в опытной группе были выше нормы на 39,0–78,1 % (р<0,05), но были ниже по сравнению с группой животных, получавших стандартное лечение, на 28,8–29,9 % (р<0,05). Значения общего билирубина на всем протяжении эксперимента были достоверно выше исхода на 14,4–48,7 % (р<0,05), а на первые, третьи и пятые сутки достоверно ниже значений в контрольной группе на 10,4–17,0 % (р<0,05) соответственно (рис. 2).
Полученные данные свидетельствуют о благоприятном действии внутрисосудистого лазерного облучения крови на функциональную активность печени, что подтверждалось снижением активности трансаминаз и уровня общего билирубина в плазме крови.
Применение лазерного облучения крови привело к изменениям функциональной активности почек. Содержание креатинина плазмы превышало норму на протяжении всего эксперимента на 19,6–33,9 % (р<0,05), достоверно не отличаясь от нее на 5-е сутки. По сравнению с контролем, значения показателей в группе животных, получающих лазеротерапию, были ниже на 13,4–31,4 % в течение всего послеоперационного периода. Содержание креатинина мочи на протяжении всего опыта было достоверно выше нормы на 6,0–10,1 % (р<0,05) соответственно. Относительно контрольных величин данный показатель также достоверно отличался в день операции, незначительно превышая контрольные цифры, а впоследствии был ниже на 5,2–13,1 % (р<0,05) соответственно (рис. 3).
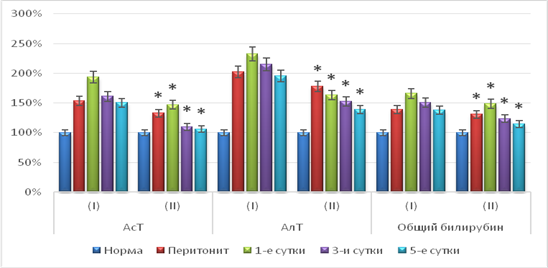
Рис. 2. Некоторые биохимические маркеры функциональной активности печени при эндотоксикозе на фоне применения лазеротерапии. (I – показатели контрольной группы; II – показатели опытной группы; * - достоверность изменения показателей относительно группы контроля, р<0,05)
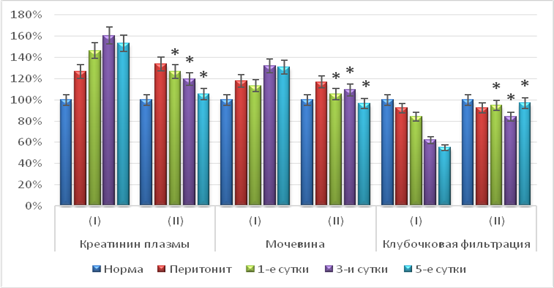
Рис. 3. Биохимические и функциональные показатели почек на фоне применения лазеротерапии. (I – данные контрольной группы исследований; II – данные опытной группы исследований; * - изменения показателей, достоверные по отношению к контрольному уровню р<0,05)
Содержание мочевины в день операции и на третьи сутки было достоверно выше нормы на 17,0 и 9,5 % соответственно (р<0,05), на пятые сутки – ниже нормы на 3,5 % (р<0,05). На первые сутки послеоперационного периода исследуемый показатель существенно от нормы не отличался. Содержание мочевины в раннем послеоперационном периоде было достоверно ниже контрольных значений на 7,2–26,3 % (р<0,05). Уровень остаточного азота в день операции и на третьи сутки после нее было достоверно выше нормы на 11,2 и 11,8 % (р<0,05), на первые и пятые сутки – существенных отличий не выявлено. Относительно данных контрольной группы показатели остаточного азота в опытной группе на этапах периода наблюдения были достоверно ниже на 2,2–17,2 % (р<0,05) соответственно. Минутный диурез был достоверно ниже нормы на первые и пятые сутки комплексной терапии на 13,3 и 8,3 % (р<0,05) соответственно. От данных группы контроля значения минутного диуреза в опытной группе достоверно отличались на третьи и пятые сутки терапии, превышая их на 34,1 и 34,2 % соответственно (р<0,05). Показатель клубочковой фильтрации был ниже нормы на 7,5–15,7 % начиная с момента моделирования перитонита, но на пятые сутки достоверно от нее не отличался. По сравнению с идентичным показателем в контрольной группе отмечено его существенное повышение на 12,3–76,4 % (р<0,05). Канальцевая реабсорбция в опытной группе животных была достоверно ниже нормы в день моделирования перитонита и на первые сутки послеоперационного периода на 9,0 и 11,8 % (р<0,05), впоследствии существенно от нее не отличаясь. Вместе с тем значения показателя канальцевой реабсорбции достоверно превосходили данные контрольной группы на третьи и пятые сутки на 5,7 и 42,1 % (р<0,05) соответственно (рис. 3).
Таким образом, применение лазеротерапии в составе комплексного лечения острого перитонита приводит к уменьшению (препятствует прогрессированию) функциональных нарушений печени и почек, а, следовательно, и явлений эндогенной интоксикации.
Выводы:
1. Синдром эндогенной интоксикации, развивающийся при остром экспериментальном перитоните, сопровождается нарушением функциональной способности печени и почек к элиминированию токсинов.
2. Применение лазеротерапии в составе комплексного лечения острого перитонита позволяет предотвратить прогрессирование нарушений функции почек и печени, что является одним из значимых факторов уменьшения эндоинтоксикации.
Рецензенты:
Смолькина А.В., д.м.н., профессор кафедры госпитальной хирургии медицинского факультета им. Т.З. Биктимирова ФГБОУ ВПО «Ульяновский государственный университет», г. Ульяновск;
Рубцов О.Ю., д.м.н., профессор кафедры факультетской хирургии ФГБОУ ВПО «Мордовский государственный университет им. Н.П. Огарёва», г. Саранск.



