Актуальность
Острые кишечные инфекции (ОКИ) занимают одно из ведущих мест в структуре инфекционной заболеваемости и приводят к существенным экономическим затратам в сфере здравоохранения. В 2013–2014 г. зарегистрирован рост заболеваемости острыми кишечными инфекциями (ОКИ) установленной и неустановленной этиологии. Заболеваемость ОКИ, вызванными установленными бактериальными и вирусными возбудителями, включая пищевые токсикоинфекции установленной этиологии, составила 153,4 на 100 тыс. населения (2012 г. – 154,8, 2011 г. – 149,5). Показатель заболеваемости детей до 17 лет составил 671,1 на 100 тыс. (2012 г. – 670,9, 2011 г. – 649,3), при этом наиболее пораженными группами являлись дети до 1 года (показатель заболеваемости – 2654,3 на 100 тыс.) и дети 1—2 лет (2175,9 на 100 тыс.) [1, 2].
Существенно выросла эпидемиологическая роль условно-патогенных микроорганизмов, в том числе условно-патогенных энтеробактерий (УПЭБ) и вирусов [1, 4, 7]. Одно из ведущих мест среди представителей условно-патогенных микроорганизмов (УПМ) занимает К. pneumoniae, на долю которой приходится от 11,2 до 54,2% [11].
ОКИ, вызванные УПФ, развиваются, как правило, на фоне снижения местной неспецифической резистентности и развития дисбиоза кишечника, что нередко приводит к повторным их эпизодам. Это свидетельствует о целесообразности использования препаратов с иммуномодулирующими и противовоспалительными свойствами. К числу таких препаратов можно отнести бактериофаги — иммунобиологические препараты антибактериального действия, способные уничтожать бактерии, устойчивые к антибиотикам, не вызывающие побочных эффектов и сочетающиеся с любыми лекарственными препаратами [9, 11]. Высокими специфическими антибактериальными свойствами, а также способностью снижать токсигенные и вирулентные свойства бактерий, и, как следствие, повышать их чувствительность к антибактериальным препаратам, обладает лактоглобулин [2, 9]. В последнее время появился также ряд исследований об аминодигидрофталазиндионе натрия (Галавит®), обладающем способностью воздействовать на функционально-метаболическую активность макрофагов, ингибировать активность провоспалительных цитокинов и стимулировать синтез противовоспалительных цитокинов [8].
Известно, что цитокинам принадлежит важная роль в развитии и течении заболеваний различных органов и систем, в тои числе и органов пищеварения. Цитокины обладают широким спектром биологических свойств: индуцируют и регулируют такие физиологические и патологические процессы, как рост, пролиферация, старение клеток, апоптоз, гемопоэз, воспаление, иммунный ответ, метаболизм, регенерация тканей и др. Также цитокины принимают непосредственное участие в формировании неспецифической защиты и специфического иммунитета, образующих в комплексе единую интегративную клеточно-гуморальную систему защиты организма [10]. Следует брать во внимание, что в настоящее время идентифицировано более 100 цитокинов и их число продолжает увеличиваться. Среди цитокинов выделяют следующие группы: интерлейкины (ИЛ-1-25), интерфероны (ИФ α, β, ɣ), факторы некроза опухоли (ФНО α, β), колониестимулирующие факторы, факторы роста, хемокины. У здоровых людей содержание цитокинов минимально, вместе с тем при патологических состояниях их уровень резко возрастает. Индукторами служат инфекционные агенты, продукты их жизнедеятельности, токсины, метаболиты и др. [8].
Следовательно, именно цитокины отражают всю картину иммунного ответа и могут служить одним из критериев эффективности различных схем лечения при тех или иных заболеваниях.
Цель работы
Изучить цитокиновый профиль в кишечнике у лабораторных мышей с экспериментальной клебсиеллезной инфекцией и при ее лечении различными иммуномодулирующими препаратами.
Материалы и методы
Экспериментальный клебсиеллез, вызванный штаммом Klebsiellapneumonia № 7571, воспроизводили на 40 белых лабораторных беспородных мышах весом 12–14 г путем перорального введения суточной культуры Klebsiellapneumonia № 7571 из расчета 1 млрд МЕ на животное. Наблюдение и отбор проб фекалий проводили на 2-й, 6-й и 9-й день после заражения. Ежедневно проводили оценку состояния животных. Мышей рандомизировали по группам поровну по 10 особей в зависимости от используемых для лечения препаратов. 1-я группа была контрольной, терапия животным в ней не проводилась. Во 2-й группе животные получали аминодигидрофталазиндион натрия (АДГФНа). В 3-й группе состояли мыши, которым вводили одномоментно АДГФНа и бактериофаг (пиобактериофаг поливалентный очищенный жидкий «Микроген»). Лабораторные животные 4-й группы получали комплекс препаратов: АДГФНа, пиобактериофаг и лактоглобулин против условно-патогенных бактерий и сальмонелл (ФБУН «РостовНИИ микробиологии и паразитологии» Роспотребнадзора). Все препараты вводили перорально в дозах в пересчете на 1 г массы животного ежедневно в течение 9 дней от начала эксперимента. Смывы фекалий использовали для определения уровня цитокинов. Между отдельными цитокинами существуют сходства, поэтому в нашем исследовании мы выделили несколько особо ярких представителей некоторых групп цитокинов: ИЛ- 1-бета; ИЛ-4, ИЛ-6, ИЛ-10. Альфа-ФНО, ИНФ-гамма и ПКТ определяли в фекалиях мышей с использованием коммерческих наборов «Вектор-бест» (Новосибирск).
Результаты и обсуждение
В ходе исследования оказалось, что динамика изменения цитокинового профиля в экспериментальных группах существенно отличалась в зависимости от схемы терапии.
Данные, полученные в ходе нашего эксперимента, приведены отдельно по каждому из изученных цитокинов, в зависимости от их изменения в различных группах.
В 1-й группе уровень ИЛ-1β резко поднялся к 3-му дню эксперимента, но к концу снизился. Во 2-й группе уровень ИЛ-1β оставался на минимальном уровне все дни эксперимента, что говорит о почти полном подавлении воспалительной реакции. В 3-й и 4-й группе к 3-му дню ИЛ-1β оказался на одной отметке. При этом в 3-й группе уровень ИЛ-1β так и не снизился (рис. 1).
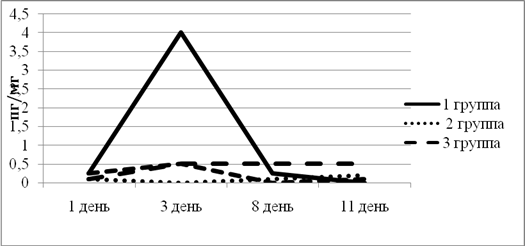
Рис. 1. Динамика изменения ИЛ-1β в экспериментальных группах животных
ИЛ-6 выполняет как про-, так и противовоспалительные функции. Исходный уровень цитокина в экспериментальных группах находился примерно в одной точке. Максимальный подъем на третий день эксперимента наблюдался в 1-й и 3-й группе. Далее в 3-й группе уровень ИЛ-6 плавно снизился, что говорит об отсутствии противовоспалительного эффекта, в то время как в 1-й группе к 8-му дню эксперимента ИЛ-6 резко снизился, а к 11-му дню вновь поднялся. Во 2-й группе уровень ИЛ-6 к 3-му дню оставался на исходном уровне, что указывает на подавление воспаления. К 8-му дню ИЛ-6 повысился, демонстрируя свои противовоспалительные функции, и плавно снизился к концу эксперимента (рис. 2).
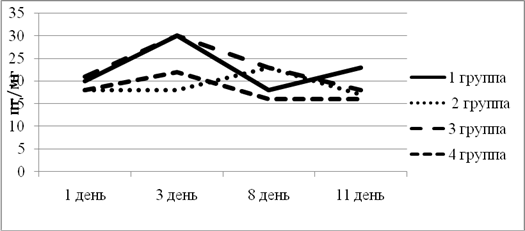
Рис. 2. Динамика изменения ИЛ-6 в экспериментальных группах животных
Исходный уровень ИФ-ɣ в 1-й группе был выше относительно других групп. К 3-му дню эксперимента снизился и оставался на одном уровне до конца эксперимента. Во 2-й, 3-й, 4-й группе изначальный уровень находился в одной точке. Во 2-й группе ИФ-ɣ повысился только к концу эксперимента, что говорит о выработке ответа на воспаление (рис. 3).
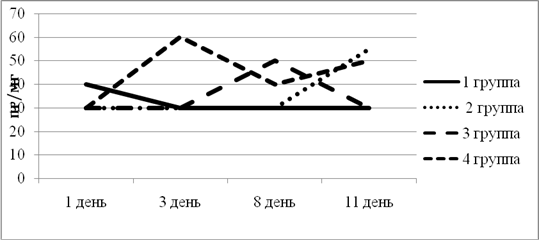
Рис. 3. Динамика изменения ИФ-ɣ в экспериментальных группах животных
На диаграмме можно заметить, что изначальная точка у всех групп была примерно на одном уровне. Что касается динамики изменения уровня ИЛ-4, то во всех группах наблюдалось плавное снижение. Во 2-й группе уровень ИЛ-4 перестал снижаться после 3-го дня эксперимента. В целом, подобную картину можно объяснить тем, что подавление воспалительной реакции не требует увеличения уровня противовоспалительного цитокина (рис. 4).
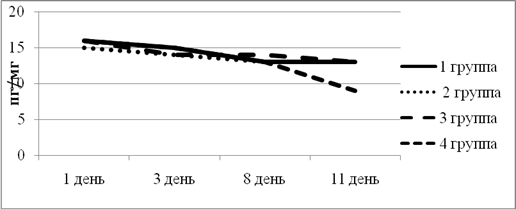
Рис.4. Динамика изменения ИЛ-4 в экспериментальных группах животных
ИЛ-10 обладает мощным противовоспалительным эффектом, регулирует интенсивность воспалительных и регенераторных процессов, ингибирует фиброз и атрофию в тканях. Повышение уровня данного интерлейкина более специфично для хронических патологий ЖКТ. Уровень ИЛ-10 в 1-й группе не менялся на протяжении всего эксперимента и был на достаточно высоком уровне. Во 2-й группе уровень ИЛ-10 снизился до 200 пг/мг, но к концу эксперимента достиг исходного уровня, что указывает на эффективность схемы лечения во 2-й группе. Во 2-й и 3-й группах к 11-му дню плавно снизился (рис. 5).
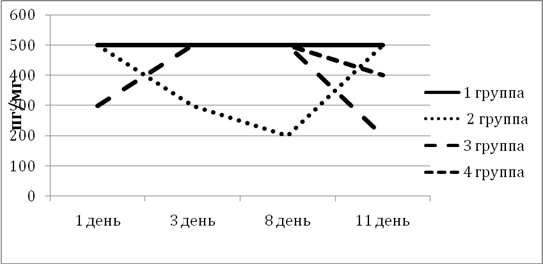
Рис. 5. Динамка изменения ИЛ-10 в экспериментальных группах животных
ФНО запускает каскад воспалительных и регенераторных реакций. Во всех группах изначальный уровень ФНО был достаточно высоким, по прошествии же эксперимента уровень плавно снижался, что свидетельствовало о том, что все схемы лечения в равной степени проявили свои иммуномодулирующие свойства. Проще говоря: если процесс воспаления подавляется, то и уровень воспалительного цитокина остается на низком уровне (рис. 6).
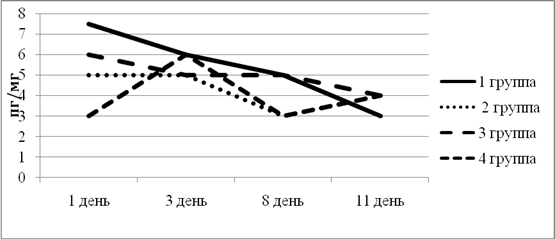
Рис. 6. Динамика изменения ФНО в экспериментальных группах животных
ПКТ является воспалительным цитокином. Повышение его уровня свидетельствует о наличии в организме инфекционного агента, а также может спрогнозировать течение заболевания. ПКТ является специфичным для определения его в сыворотке крови, в то время как в нашем исследовании использовались супернанты фекалий. Результаты рознились во всех группах, о чем свидетельствует диаграмма, которую мы расценили как не являющуюся информативной[12] (рис. 7).
Рис. 7. Динамика изменения PCT в экспериментальных группах животных
Заключение
Данные, приведенные выше, свидетельствуют, что препараты, обладающие противовоспалительной и иммуномодулирующей активностью, корригируют и стабилизируют цитокиновый профиль. Результаты эксперимента позволяют рассматривать целесообразность использования подобных препаратов, таких как аминодигидрофталазиндион натрия, в комплексном лечении острых кишечных инфекций (ОКИ), вызванных условно-патогенной флорой (УПФ).
Рецензенты:
Амбалов Ю.М., д.м.н., проф., зав. кафедрой инфекционных болезней, Ростовский Государственный Медицинский Университет, г. Ростов-на-Дону;
Яговкин Э.А., д.м.н., заместитель директора по научно-производственной деятельности, ФБУН «Ростовский научно-исследовательский институт микробиологии и паразитологии» Роспотребнадзора, г. Ростов-на-Дону.



