К настоящему времени имеют место многочисленные исследования предполагающие участие Helicobacter pylori в развитии различных заболеваний человека. К заболеваниям, с доказанной этиологической значимостью H.pylori, относят антральный неатрофический хронический гастрит (типа В), язвенную болезнь, дистальный рак желудка и MALT-лимфомы [1]. Но также имеются работы, связывающие H.pylori с аутоиммунной тромбоцитопенией, эссенциальной железодефицитной анемией, синдромом Рейно, аутоиммунным тиреоидитом, токсикозами беременных, атопическими дерматитами и др. [2, 3].
В последние годы особое внимание привлекает возможная связь бактерий рода Helicobacter с развитием поражений печени и желчевыводящих путей у человека. К настоящему времени можно считать доказанной роль энтерогепатических хеликобактеров H.bilis. H.hepaticus, H.canis, H.cholecystis, H.pullorum, H.rodentium и H.rappini в этиопатогенезе воспалительных заболеваний печени и желечевыводящих путей, карцином печени различного типа у разнообразных млекопитающих. В тоже время установлены факты обнаружения этих бактерий либо их нуклеиновых кислот при различных гепатобилиарных патологиях у человека [4, 5]. Кроме того, выявлено присутствие H.pylori в желчевыводящих путях при различных хронических воспалительных заболеваниях [6, 7].
Известно, что хронические воспалительные заболевания желчевыводящих путей являются наиболее распространенными формами гепатобилиарной патологии человека [8]. Большинство авторов склоняется к полиэтиологичной природе заболевания, при этом, одним из важных факторов является чаще восходящая энтерогенная, реже нисходящая гемато- и лимфогенная колонизация желчевыводящих путей микроорганизмами [9]. В то же время ряд исследователей отдает предпочтение роли бактериальной колонизации в патогенезе желчекаменной болезни [10].
Известно, что хроническая желчекаменная болезнь сопровождается существенными морфологическими изменениями эпителия желчного пузыря. Как правило, они бывают связаны с патологическими состояниями и процессами, предшествующими образованию и росту камней, либо с миграцией камней по полости пузыря и закупоркой желчных протоков.
Цель – изучить морфологические изменения желчевыводящих путей при хронических холециститах, в том числе на фоне инфицирования H.pylori.
Материал и методы исследования.
Материалом для исследования служили 32 биоптата слизистой оболочки желчного пузыря, отобранных у больных с желчекаменной болезнью при оперативном вмешательстве (холецистоэктомии).
Все биоптаты слизистой оболочки были подвергнуты бактериологическому и молекулярно – генетическому исследованию на наличие H.pylori.
Для выделения H. pylori биоптаты помещали в транспортную тиогликолевую среду и в течение 2–3 часов доставляли в лабораторию. Посевы производили на эритрит–кровяной и кровяной агары, дополненные амфотерицином В, культивировали в течение 5 суток в микроаэрофильных и капнофильных условиях при 37 оС. Идентификацию H.pylori проводили по морфологическим признакам при микроскопии мазков–отпечатков и мазков желчи, окрашенных по Граму и фуксином; наличию характерной «винтообразной» подвижности, выявляемой фазово-контрастной микроскопией и уреазной активности в СLO – тесте.
Обнаружение ДНК H.рylori проводили методом, предложенным научно-производственной фирмой «Литех» [Момыналиев К.Т. и др., 2003]. Определяемыми фрагментами ДНК H.pylori являлись участки гена ureC. Результаты документировали с помощью видеосистемы для регистрации «DNA Analyzer» («Литех», Москва). Образцы, положительные по гену ureC, в дальнейшем использовали для генотипирования по генам вирулентности H.pylori. Генотипирование выделенных штаммов H.pylori на наличие генов cagA, vacA (субтипы s1, s2, m1 и m2), babA проводили с использованием наборов реагентов НПФ «Литеx» (Москва).
При диагностировании морфологических изменений слизистой оболочки желчного пузыря биоптаты фиксировали 10% раствором нейтрального формалина с последующей проводкой через спиртовую батарею в автоматизированном процессоре ТР 1020 (Leica, Германия) и заливкой в парафин. Гистологические срезы готовили на санном микротоме и окрашивали гемотоксилином и эозином. Для описания и количественного микроскопического исследования применяли систему анализа изображений (микроскоп Nikon Eclipse E200, цифровой фотоаппарат Olympus SP 350, компьютер с операционной системой Windows XP, графический редактор Adobe Fotoshop 7.0 и программное обеспечение Taucom).
Результаты.
При бактериологическом исследовании 32 биоптатов слизистой оболочки желчного пузыря H.рylori обнаружен в 8 образцах (25,0 ±7,7%).
Для оптимизации оценки частоты колонизации H.рylori желчевыводящих путей методом ПЦР были протестированы 24 образца биоптатов оболочки желчного пузыря больных желчекаменной болезнью. ДНК бактерий была обнаружена в 16 (66,6±9,6%) биоптатах слизистой оболочки желчного пузыря. Штаммы H.pylori, выделенные из слизистой оболочки желчного пузыря, представлены генотипом vacAs1/m2+ 11 (45,8± 10,2%), vacA m2 + 11 (45,8± 10,2%), vacA s1+ 16(66,6%±9,6%), babA-, cagA-.
В проведенных нами гистологических исследованиях был установлен достаточно широкий спектр патоморфологических изменений слизистой желчного пузыря. Было выявлено наличие явлений атрофии, сглаживание складок слизистой и склероз подлежащих слоев. Также отмечены признаки травматизации слизистой оболочки конкрементами по типу асептического воспаления. В просвете пузыря присутствовали слизь, слущеный эпителий и лейкоциты. Отмечено истончение стенок, утрата на внутренней поверхности желчного пузыря нормальной нежной складчатости, которая испещрена кровоизлияниями, язвами и рубцами. Гистологически в стенке пузыря были обнаружены лимфоцитарные и плазмоклеточные инфильтраты, разрастание соединительной ткани. Нервные волокна находятся в состоянии зернистого распада, а ганглиозные клетки в состоянии некробиоза.
В биоптатах слизистой оболочки желчного пузыря пациентов, перенесших холецистоэктомию, у которых не был установлен факт микробной колонизации, выявлены явления атрофии, сглаживание складок слизистой и склероз подлежащих слоев (рисунок 1).
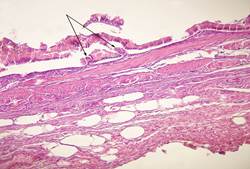
Рис.1. Стенки желчного пузыря при желчекаменной болезни. Окраска гематоксилин – эозином. Об.ок.х100. Гипотрофия слизистой оболочки стенки желчного пузыря с урежением ворсин, ворсинки деформированы (низкие, каплевидные)
Гистологические исследования слизистой желчного пузыря больных при желчекаменной болезни, у которых был установлен факт инфицирования его микроорганизмами, отличными, от Н.pylori, выявлены многочисленные и разнообразные признаки воспалительного процесса стенки желчного пузыря.
В частности, имели место признаки гиперплазии (аденоматоз, аденомиоматоз, полипоз, наличие глубоких погружных ходов в стенке желчного пузыря), гипо- и атрофические процессы: уплощение рельефа, истончение слизистой оболочки и мышечного слоя со значительным урежением и деформацией ворсин стенки желчного пузыря (рисунок 2).
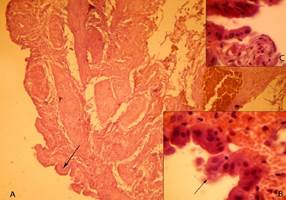
Рис.2. Стенка желчного пузыря при желчекаменной болезни. Окраска гематоксилин-эозином. Гипотрофия слизистой оболочки стенки желчного пузыря с урежением ворсин, ворсинки деформированы (низкие, «грибовидные»),об. ок.х100 (А), дистрофия покровного эпителия, апикальная десквамация, пристеночное и внутристеночное наличие микрофлоры, об. ок.х1000 (В). Очаги тотальной десквамации эпителия с наличием образований, напоминающих «карманы», внутри которых видно присутствие микрооганизмов, об. ок.х1000 (С)
Были выявлены признаки слизисто – серозного воспаления (очаговое утолщение слизистой оболочки, гиперемия, гиперсекреция слизи, минимальное усиление клеточной инфильтрации поверхностных слоев слизистой оболочки, дистрофия эпителия с набуханием и гипохромностью ядерных структур). Также отмечена межэпителиальная инвазия микроорганизмов. Обращал на себя внимание тот факт, что среди дескваматов измененных эпителиоцитов была значительная примесь желчи с образованием холестазов и формирующиеся конгломераты холестериновых камней. В цитоплазме части эпителиальных клеток обнаружены зерна бурого пигмента и мелкоочаговый холестероз – очаговое отложение масс, напоминающих холестерин в подслизистой оболочке.
Гистологические исследования слизистой желчного пузыря больных желчекаменной болезни, у которых был установлен факт инфицирования его микроорганизмами в ассоциациях с Н.pylori, выявлены многочисленные и разнообразные признаки воспалительного процесса стенки желчного пузыря. В частности, имели место признаки гиперплазии (аденоматоз, аденомиоматоз, полипоз, наличие глубоких погружных ходов в стенке желчного пузыря), гипо- и атрофические процессы: уплощение рельефа, истончение слизистой оболочки и мышечного слоя со значительным урежением и деформацией ворсин стенки желчного пузыря.
Проведенные патоморфологические исследования показали, что хроническая колонизация микроорганизмами желчевыводящих путей приводит к развитию более выраженных изменений стенки желчного пузыря. Вполне возможно, что в развитии подобных морфологических изменений определенная роль принадлежит и H.pylori, т.к. его обнаружение в исследуемых гистологических препаратах, дает основание предположить его участие в поддержании воспаления в слизистой оболочки желчного пузыря.
На возможную этиологическую значимость H.pylori может указывать и факт выделения бактерий из желчевыводящих путей больных с хроническими воспалительными заболеваниями гепатобилиарной системы в виде монокультуры, при отсутствии прочих микроорганизмов. Однако наши предположения требуют дальнейшего изучения.
Вывод: Микробную колонизацию слизистой желчного пузыря при холециститах сопровождают более выраженные морфологические изменения, по сравнению с характером деструкции эпителия у пациентов с неинфицированными желчевыводящими путями.
Рецензенты:
Мусина Л.Т. д.м.н., профессор, ГБОУ ВПО «Казанский государственный медицинский университет» Министерства здравоохранения Российской Федерации, г. Казань;
Ильинская О.Н., д.б.н., профессор, ФГАОУ ВО Казанский (Приволжский) Федеральный Университет Министерства образования и науки Российской Федерации, г. Казань.



