Врожденный порок сердца (ВПС) часто приводит к нарушению системной гемодинамики, формируя предпосылки для тканевой гипоксии. Известно, что в основе любой формы гипоксии лежит недостаточность ведущей клеточной энергопродуцирующей системы – митохондриального окислительного фосфорилирования с прогрессирующим дефицитом АТФ [3]. По мнению Лукьяновой Л.Д. (2011), гипоксия одновременно способна мобилизовать тканевые ресурсы организма, создавая условия для срочной и долгосрочной адаптации, которая контролируется межклеточными и внутриклеточными регуляторными механизмами. По мнению ряда исследователей гипоксия активизирует в физиологически важных местах регуляции кислородных путей гипоксия-индуцибельный фактор (hypoxia-inducible factor – HIF). Он считается ведущим транскрипционным регулятором генов млекопитающих, ответственных за реакцию на недостаточность кислорода. HIF обеспечивает быстрые и адекватные ответы на гипоксический стресс. Кроме этого, он может стать причиной развития эндотелиальной дисфункции [2]. Недостаток кислорода является основным стимулом активации образования новых сосудов при физиологических и патологических состояниях [6].
Цель работы: изучить интенсивность процесса неоваскулогенеза в тимусе у детей первого года жизни при гипоксии, обусловленной ВПС разной степени выраженности.
Материалы и методы. Исследование проведено на биоптатах тимуса (n=77), полученных во время операций от детей, в возрасте до 11 мес., при коррекции врожденных пороков сердца. Тимэктомия проводилась в соответствии с существующей хирургической практикой Федерального краевого центра сердечно-сосудистой хирургии г. Перми. Исследования проводили согласно Хельсинской Декларации ВМА 2000 г. и протоколу Конвенции Совета Европы о правах человека и биомедицине 1999 г. Критериями включения явилось наличие добровольного согласия на обследование со стороны законных представителей несовершеннолетних детей.
В патогенезе врожденных пороков сердца лежит механизм нарушения системной гемодинамики, зависящий от сложности сердечного порока, и вызывающий цианоз слизистых и кожных покровов. По наличию цианоза, было выделено 2 группы: 1-я – тимус (n=35) от детей с белыми пороками сердца, без цианоза слизистых и кожных покровов (дефект межжелудочковой перегородки; дефект межпредсердной перегородки). Возраст детей от 1 до 11 месяцев; 2-я – тимусы (n= 42) от детей с более выраженной патологией – синие пороки сердца, вызывающие цианоз (тетрада Фалло; аномалия Эбштейна; транспозиция магистральных сосудов), в возрасте от 1 до 11 месяцев. Исследование проводили в возрастной динамике: 1 мес., 6 мес. и 11 месяцев. В качестве группы сравнения, исследованы тимусы от случайно погибших детей (n=6) в возрасте от 9 до 12 месяцев.
Биоптаты тимуса фиксировали в 10 % нейтральном формалине на фосфатном буфере (рН 7,2). Иммуногистохимическое исследование проводили моноклональными антителами (Dako, США): 1) CD34 – маркер гемопоэтических клеток костномозгового происхождения используется для идентификации прогениторных клеток; 2) CD31 – для идентификации эндотелиальных клеток. Для визуaлизaции рeзультaтoв использовали системы дeтeкции Ultra Visiоn ONE Dеtесtiоn Systеm HRP Pоlymеr. Для оценки качества реакции использовали стекла с позитивным контролем для каждого из антигенов (фирма Labvision, США).
Морфометрическое исследование и съемку препаратов проводили с использованием системы компьютерного анализа, с последующей обработкой полученных изображений в программе Image PRO+ (free version). Экспрессию СD 31 и CD34 определяли измерением площади положительной реакции клеток в пикселях (pix) в каждом случае в десяти полях зрения. Плотность сосудов определяли с помощью открытой тестовой системы (программа Image J).
Полученные результаты обработаны с помощью пакетов MicrosoftExcel 2007 и Statistica 6,0. Для статистического анализа использовались непараметрические критерии. В результатах представлены средние значения со стандартными отклонениями. Различие оценивалось с помощью критерия Манна-Уитни. За статистически значимые результаты принималась величина ошибки р=0,05.
Результаты исследования. В группе с белым типом ВПС, в ранний срок наблюдения (1 месяц) прогениторные клетки (CD34+) в тимусе выявляются в междольковых перегородках вблизи крупных кровеносных сосудов. Экспрессия белка CD34 имеется и в клетках соединительной ткани, принадлежащих к фибробластическому дифферону. Они залегают вдоль междольковых и корковых перегородок. В субкапсуллярной зоне под базальной мембраной CD34+ клетки расположены диффузно или группой по - 2-3 позитивно окрашенные клетки. В пределах коркового вещества CD34+ клетки присутствуют в стенке поперечно срезанных капилляров, часть из них обнаруживали в продольном срезе, в виде мелких трубочек.
К 6 месяцу наблюдения в корковом веществе растет численность капилляров, что увеличивает их плотность расположения (р=0,002). Капилляры представлены трубчатыми структурами, их стенка выстлана позитивно окрашенными клетками к CD34.
В пределах коркового вещества и ближе к кортико-медуллярной границе образование новых капилляров верифицируется в виде нежных сплетений из CD34+ .
Таблица 1
Экспрессия CD34 в корковом веществе дольки тимуса при ВПС белого типа (компьютерная морфометрия) pix
|
возраст Группы |
контроль |
1 месяц |
6 месяцев |
11 месяцев |
|
Плотность сосудов |
9,58±0,59 |
9,96±0,64 |
11,11±0,76* |
13,96±0,99* |
|
Площадь экспрессии |
1662,34±191,42 |
1430,68±122,88* |
1732,83±153,65 |
1962,80±230,74* |
Примечание: * – значимые различия (p˂0,05) между группами по отношению к контролю по парному двухвыборочному t-тесту (M±m).
К 11 месяцу количество сосудистых трубочек продолжает достоверно увеличиваться, что проявляется в плотности расположения сосудов в поле зрения (р=0,0001) и, занимаемой общей площади экспрессии CD34, которая также вырастает (таблица 1).
Наиболее интенсивно неоваскулогенез идет в кортико-медуллярной зоне. В этой части дольки тимуса формируются скопления продольно идущих линий, переходящие в трубчатые образования и, врастающие в мозговое вещество (рис. 1).
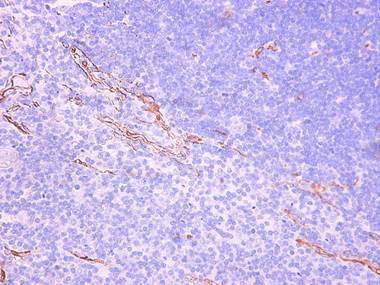
Рис. 1. Образование сосудов (CD34+) в кортико-медуллярной зоне тимуса.
Белый тип ВПС. 11 месяцев. Увеличение Х100
Интенсивный процесс неоваскулогенеза в тимусе наблюдается и в группе синего типа ВПС. Во все сроки исследования (1мес., 6 мес., 11 мес.) в сосудах междольковых перегородок эндотелий имеет положительное окрашивание к CD34. Сосуды лежат в окружении клеток соединительной ткани, имеющих экспрессию CD34. В непосредственном контакте с сосудами и в местах скопления жировой ткани находятся позитивно окрашенные клетки, концентрируясь вдоль перегородок, и проникающих в субкапсульную зону дольки.
При этом типе порока, в 1-й месяц васкулогенез идет в корковом веществе и особенно интенсивно в кортико-медуллярной зоне. К 6-му месяцу формируются цепочки из клеток, которые дифференцируются в клетки эндотелия, образуя новые сосуды, что достоверно повышает плотность расположения сосудов и увеличивает площадь экспрессии CD34 (таблица 2). В 11 месяцев в кортико-медуллярной зоне молодые сосуды формируют сеть или лежат в виде тонких линейных трубчатых образований, выстланных CD34 положительными клетками (рис. 2). В этот срок верифицируется развитие капилляров в мозговом веществе, что в предыдущем сроке исследования (6 мес.) наблюдалось только в единичных случаях. Интенсивность васкулогенеза существенно увеличила плотность расположения сосудов в поле зрения. По сравнению с группой контроля она увеличилась в 2 раза (р=0,00007). Общая площадь экспрессии CD34 к концу сроков наблюдения выросла в 1,7 раза (таблица 2).
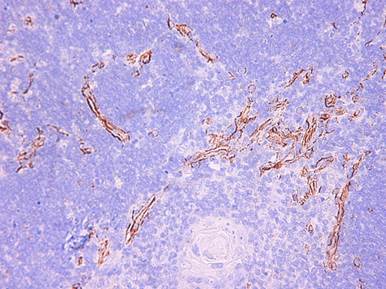
Рис. 2. Васкулогенез в кортико-медуллярной зоне. Экспрессия CD 34 в стенке новых сосудов. Синий тип ВПС. 11 месяцев. Увеличение: А - Х100
Таблица 2
Экспрессия CD34 в корковом веществе дольки тимуса при ВПС синего типа (компьютерная морфометрия) pix
|
возраст Группы |
контроль |
1 месяц |
6 месяцев |
11 месяцев |
|
Плотность сосудов |
9,58±0,59 |
13,22±0,84* |
13,89±1,25* |
19,15±1,70* |
|
Площадь экспрессии |
1662,34±191,42 |
1489,84±52,64* |
1872,38±209,17 |
2834,75±487,89* |
Примечание:* – значимые различия (p˂0,05) между группами по отношению к контролю по парному двухвыборочному t-тесту (M±m).
Оценка площади CD 31+ показала низкую экспрессию в тимусах обеих групп ВПС по отношению к группе контроля (рис. 3). При белом типе ВПС положительное окрашивание эндотелия регистрируется преимущественно в крупных сосудах междольковых перегородок, и в единичных случаях – в капиллярах коркового вещества и в кортико-медуллярной зоне. К 11 месяцу верифицируется рост экспрессии маркера CD31. Особенно интенсивно окрашиваются сосуды в кортико-медуллярной зоне и по периферии мозгового вещества.
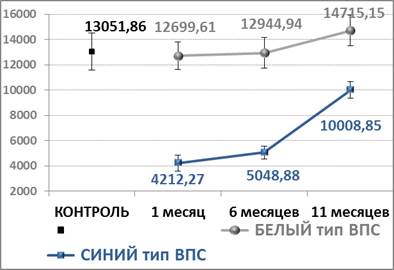
Рис. 3. Площадь экспрессии CD31 в тимусе при ВПС разного типа в сравнении с группой контроля. По результатам компьютерной морфометрии (pix) (динамика, M±m)
Увеличение занимаемой площади CD31 к 11 месяцу имеет прямую корреляцию по отношению к предыдущему сроку (6 мес.): r=0,459 (р=0,007), показатели которого уступали контрольной группе. К концу сроков исследования площадь экспрессии CD31, превысила показатели контрольной группы, но достоверной разницы не имела. В результате, к 11 месяцу имеется слабая динамика роста накопления CD31 в клетках эндотелия сосудов. Это определяет обратную корреляцию по отношению к площади экспрессии CD34 (r= - 0,594; р=0,0003) в тот же срок исследования.
При синем типе ВПС в 1-й и 6-й месяцы в пределах дольки экспрессия CD31 выявляется эпизодически. Имеющиеся сосуды редко реагируют на маркер. В результате, площадь экспрессии CD31 меньше, чем в группе контроля в 3 раза. К 11 месяцу эндотелиального маркера адгезии становится значительно больше, но общая его площадь всё ещё остается ниже уровня контрольной группы.
Обсуждение. Анализируя полученные результаты, можно говорить, что в тимусе независимо от степени выраженности гипоксии запускаются механизмы неоваскулогенеза проявляющиеся дифференцировкой прогениторных клеток (CD34+) в клетки сосудистой стенки с образованием примитивной капиллярной сети. Известно, что гипоксия разного генеза способствует увеличению плотности сосудов [7, 9]. В наших исследованиях, в обеих группах ВПС на протяжении всего периода наблюдений в поле зрения тимуса увеличивается площадь экcпрессии CD34 и растет плотность сосудов. Образование сосудов в динамике имеет последовательность – от мелких разрозненно лежащих трубочек до капилляров формирующих нежную сеть. Степень выраженности гипоксии определяет интенсивность васкулогенеза, наиболее активно которая проявилась в группе синего типа ВПС.
Первоначально, в тимусах обеих групп неоваскулогенез проявляется за счет слияния клеток CD34+ присутствующих диффузно в пределах коркового вещества. Пополнение резерва прогениторных клеток наблюдается со стороны сосудов междольковых перегородок и имеющейся в них скопления жировой ткани. Известно, что в жировой ткани находятся стволовые клетки, которые секретируют большой спектр проангиогенных факторов роста и могут участвовать в неоваскулогенезе in vivo [10]. Попадая в ткань CD34+ клетки способны развиваться и в клетки сосудистой стенки – перициты [5]. По данным Банина В.В (2004), на ранних стадиях образования сосуда перициты формируют фронтальную зону почки роста капилляра, синтезируя компоненты межклеточного вещества перед миграцией эндотелиоцитов. В наших исследованиях в течение первых 6 месяцев активация прогениторных клеток (CD34+) верифицировалась в виде формирования скоплений продольно идущих линий, являющихся примитовным вариантом формирования стенки будущего сосуда. Подобный процесс в обоих случаях наиболее интенсивно верифицировали на границе коркового и мозгового вещества, места выхода тимоцитов в кровь.
По нашему мнению, на процесс миграции и дальнейшую дифференцировку прогениторных клеток (CD34+) в эндотелиоциты влияет гипоксия-индуцибельный фактор (hypoxia-inducible factor – HIF). HIF считается ведущим транскрипционным регулятором генов млекопитающих, ответственных за реакцию на недостаточность кислорода. [2, 8]. Наблюдаемая динамика васкулогенеза показала силу стимула гипоксии.
Оценка площади эндотелиального маркера CD31, независимо от степени выраженности гипоксии, показала низкий уровень его экспрессии в течение всего срока наблюдения. Особенно в группе с синим типом ВПС, где маркер CD31 в 1-й месяц исследования верифицировался в 3 раза меньше, чем в группе контроля, и это имеет отрицательную корреляцию с площадью экспрессии CD34. Уровень CD34+ в этот срок уступал контролю только в 0,8 раз (R= -0,374; p=0,0318). К концу наблюдений (11 месяц) площадь экспрессии CD31 хоть и вырос, но так и остался ниже уровня контроля, а уровень CD34+ наоборот, значительно превысил показатели контрольной группы.
Исходя из этого, следует, что гипоксия стимулирует в тимусе процессы неоваскулогенеза. Но, не смотря на образование новых сосудов, экспрессия эндотелиального маркера CD31 в группе синего типа ВПС недостаточна, и появляется позднее, что формирует предпосылки слабой функциональной активности эндотелия. Как показали наши исследования, приобретение эндотелиоцитами положительного окрашивания к маркеру CD31 в течение всего периода наблюдений идет медленно.
Таким образом, гипоксия, в зависимости от степени её выраженности, запускает в тимусе адаптационные механизмы в виде имеющихся у него резервов, при участии комплекса тканевых и клеточных взаимодействий, направленных на нормализацию кислородного дефицита. Но не всегда имеющиеся ресурсы способны восстановить недостающий баланс.
Рецензенты:
Баландина И.А., д.м.н., профессор, зав. кафедрой нормальной, топографической и клинической анатомии оперативной хирургии, ГБОУ ВПО «Пермский государственный медицинский университет им. академика Е.А. Вагнера» Минздрава России, г. Пермь;
Косарева П.В., д.м.н., зав. отдела морфологических и патофизиологических исследований ЦНИЛа ГБОУ ВПО «Пермский государственный медицинский университет им. академика Е.А. Вагнера» Минздрава России, г. Пермь.



