На протяжении последних лет во всем мире отмечается значительный рост устойчивости возбудителей внебольничных и нозокомиальных инфекций к антимикробным препаратам (АМП). Возникновение антимикробной резистентности является естественным биологическим ответом на использование АМП, которые создают селективное давление, способствующее отбору, выживанию и размножению антибиотикорезистентных штаммов микроорганизмов [5].
Возбудители внутрибольничных инфекций по-прежнему остаются одной из наиболее распространенных проблем здравоохранения всего мира с серьезным прогнозом. Общая летальность, например от пневмонии, составляет 20–30 случаев на 100 тысяч человек в год [2]. Так же результаты многих исследований указывают на зависимость этиологии внутрибольничных инфекций от тяжести заболевания. У пациентов с тяжелыми заболеваниями наиболее вероятными возбудителями внутрибольничных инфекций являются Staphylоcоccus аureus.
S. aureus является одним из самых сложных возбудителей различных угрожающих жизни инфекций из-за его высокой способности адаптироваться к изменяющимся условиям окружающей среды, в частности к действию антимикробных препаратов [1]. В этиологической структуре так же внебольничных пневмоний стафилококки составляют, по мнению различных авторов, от 0,5 до 5 %. Уровень летальности, при этом, составляет свыше 30 % [2].
Известно, что природная чувствительность стафилококков к подавляющему большинству антибактериальных препаратов достаточно высока. Поэтому в условиях роста резистентности стафилококков к антибиотикам, часто используемым в клинической практике, особую значимость приобретает поиск новых соединений, обладающих антимикробной активностью, пример тому применение новых поколений антибиотиков, таких как тигециклин, даптомицин, линезолид; использование эффективных комбинаций антибиотиков с усилением бактерицидного действия и с активностью в отношении как микробных биопленок, так и внутриклеточно расположенных бактерий [1].
Необходимо отметить, что ряд исследований, проводимых на предмет чувствительности некоторых микроорганизмов, показали, что многие химические вещества циклического строения, имеющие в структуре фторсодержащий радикал и полученные синтетическим путем, проявляли противомикробную активность, поэтому исследование новых соединений этой группы имеет актуальное значение [3]. Также, немаловажен поиск соединений, проявляющих узкий спектр противомикробной активности.
Цель исследования. Изучение противомикробной активности азотсодержащих гетеросистем, полученных из 6-амино-1,5-диметил-2-фенил-, 6-амино-5-метил-2-фенилиндолов и этилового эфира 4,4,4-трифторацетоуксуной кислоты.
Материалы и методы исследований
Исследование противомикробной активности соединений проводилось на базе бактериологической лаборатории кафедры иммунологии, микробиологии и вирусологии ФГБОУ ВПО «МГУ им. Н.П. Огарева».
В качестве препарата сравнения использован диоксидин (производство «Биосинтез», раствор для местного применения, эндотрахеального и внутривенного введения, 10 мг/мл), антибактериальный препарат, производное хиноксалина.
В качестве тест-микроорганизмов использовали музейные штаммы: Salmonella enteritidis 5765 ATСС, Shigella sonnei S-форма 20, Pseudomonas aeruginosa 27853 АТСС, Pseudomonas aeruginosa 453, Escherichia coli М17 штамм, Escherichia coli 25922 АТСС, Staphylococcus aureus 29213 АТСС, Staphylococcus aureus 906, Enterococcus faecalis 2919 АТСС, Citrobacter freundii 101/57, Proteus vulgaris 222, Klebsiella pneumoniaе 9172, Bacillus cereus 96, Streptococcus pyogenes 1238 АТСС. Музейные штаммы, используемые в работе, получены из коллекции музея живых культур ФГУН ГИСК им. Л. А. Тарасевича.
Определение чувствительности микроорганизмов к исследуемым соединениям методом серийных разведений и диско-диффузионным методом (ДДМ) проводили в соответствии с методическими указаниями МУК 4.2.1890–04 [4].
Методы статистической обработки. Статистическую обработку полученных результатов проводили методами вариационной статистики, достоверность результатов оценивали с помощью метода определения t-критерия Стъюдента. Достоверными считали результаты при Р≤0,05. В работе использовали персональный компьютер и стандартный пакет прикладных программ Statistica 6.0.
Спектры ЯМР 1Н впервые полученных соединений записаны на мультиядерном спектрометре ядерного магнитного резонанса Joel JNM-ECX400 (400 МГц) в DMSO-d6. Расчетные спектры соединений выполнены с использованием программы ACD/LABS HNMR Spectrum Generator: Chemsketch Windows. Электронные спектры сняты на приборе LEKI SS2109UV в этаноле. Масс-спектры получены на масс-спектрометре Finnigan MAT INCOS-50 с прямым вводом образца в ионный источник при энергии ионизации 70 эВ. Очистку продуктов реакции проводили методом колоночной хроматографии. В качестве сорбента использовали оксид алюминия (нейтральный, I и II ст. акт. по Брокману). Контроль за ходом реакции, чистотой полученных соединений, определение Rf осуществляли с помощью ТСХ на пластинках Silufol UV–254.
Аминоиндолы 1, 2 получены по методике, приведенной в работе [7].
9-Гидрокси-5-метил-2-фенил-9-(трифторметил)-1,6,8,9-тетрагидропирроло-[2,3-f]хинолин-7-он (3). Смесь 0,30 г (1,35 ммоль) 5-метил-2-фенил-6-аминоиндола (1) и 0,37 г (2,0 ммоль) этилового эфира трифторацетоуксусной кислоты в 200 мл абсолютного бензола, в присутствии следов ледяной уксусной кислоты нагревают 50 часов с насадкой Дина-Старка. По окончании реакции (контроль хроматографический) бензол отгоняют. Полученное вещество очищают промыванием кипящим бензолом. Выход соединения 3: 0,24 г (49 %). Т. пл. = 244–245 °С. Спектр ЯМР 1Н, d, м.д., J (Гц): 2,78 (.3Н, с, 5–СН3), 2,87 (1Н, д, J8Н8Н’=15, 8–Н), 3,17 (1Н, д, J8Н’8Н=15, 8–Н’), 6,78 (.1Н, с, 3–Н), 7,28 (1Н, т, п-2-Ph), 7,33 (.1Н, с, 4–Н), 7,36 (1Н, с, 9-OH), 7,42 (2Н, т, м-2-Ph), 7,72 (2Н, д, о-2-Ph), 9,46 (1Н, с, 6–Н), 9,77 (1Н, с, 1–Н). Масс-спектр, m/z (I отн., %): 360 (98, М+), 342 (11), 392 (22), 291 (100), 290 (12), 273 (15), 245 (16), 221 (37), 220 (11), 219 (17), 180 (17), 146 (15), 136 (13), 122 (26), 110 (24), 78 (13), 77 (17), 43 (25). УФ спектр, λ max, нм (lg ε): 207 (4,38), 255 (4,31), 338 (4,44).
N-(1,5-диметил-2-фенил-1Н-индол-6-ил)-4,4,4-трифторо-3-оксобутанамид (4) получают аналогично из 0,30 г (1,27 ммоль) 1,5-диметил-2-фенил-6-аминоиндола (2) и 0,24 г (1,30 ммоль) этилового эфира трифторацетоуксусной кислоты, но нагревают 80 ч. Выход соединения 4: 0,16 г (34 %). Т. пл. = 158–159 °С (бензол). Масс-спектр, m/z (I отн., %): 374 (1, М+), 278 (33), 263 (26), 262 (100), 261 (15), 237 (17), 236 (79), 235 (53), 234 (13), 233 (29), 221 (13), 220 (23), 219 (14), 165 (11), 131 (14),116 (14),102 (11), 89 (11), 77 (15), 69 (19), 51 (11), 44 (18), 43 (47), 43 (22), 15 (30). УФ спектр, λ max, нм (lg ε): 208 (4,62), 225 (4,63), 311 (4,58).
Результаты исследования и их обсуждение
Проведено исследование противомикробной активности 9-гидрокси-5-метил-2-фенил-9-(трифторметил)-1,6,8,9-тетрагидропирроло[2,3-f]хинолин-7-она (3) и N-(1,5-диметил-2-фенил-1Н-индол-6-ил)-4,4,4-трифторо-3-оксобутанамида (4) методом серийных разведений в бульоне по отношению к эталонным штаммам S. aureus 29213, E. coli 25922, P. aeruginosa 27853. Результаты противомикробной активности соединений 3, 4, приведены в таблице 1.
Таблица 1
Определение минимальных подавляющих концентраций (МПК) соединений 3, 4
методом серийных разведений в жидкой питательной среде
|
Тест- культура |
Staphylococcus aureus 29213 |
Escherichia coli 25922 |
Pseudomonas aeruginosa 27853 |
||||
|
исследуемое вещество |
3 |
4 |
3 |
4 |
3 |
4 |
|
|
Концентрация веществ в питательной среде, мкг/мл |
250,0 |
0 |
0 |
0 |
0 |
+++ |
0 |
|
125,0 |
+/-1 |
0 |
0 |
0 |
+++ |
0 |
|
|
62,5 |
++ |
+/-1 |
+/-1 |
0 |
+++ |
+/-1 |
|
|
31,25 |
++ |
++ |
++ |
+/-1 |
+++ |
++ |
|
|
15,7 |
+++ |
++ |
+++ |
++ |
+++ |
++ |
|
|
7,8 |
+++ |
+++ |
+++ |
++ |
+++ |
+++ |
|
|
3,9 |
+++ |
+++ |
+++ |
+++ |
+++ |
+++ |
|
|
1,9 |
+++ |
+++ |
+++ |
+++ |
+++ |
+++ |
|
|
0,9 |
+++ |
+++ |
+++ |
+++ |
+++ |
+++ |
|
|
«Отрицательный» контроль |
+/- |
+/- |
+/- |
+/- |
+/- |
+/- |
|
Примечание: – 1 титр активности, «+++» – обильный рост; «++» – глубинный или поверхностный рост штаммов менее обилен; рост слабый – неактивный менее 50–30 % (+); более 70 % задержки или отсутствие роста культуры по сравнению с контролем (+/-,0).
Для препарата сравнения диоксидина МПК относительно штаммов Staphylococcus spp. составляет 125,0–1000,0 мкг/мл, Escherichia coli 8,0–250,0 мкг/мл, Pseudomonas spp. 125,0–1000,0 мкг/мл.
Из данных таблицы 1 видно, что МПК относительно S.aureus 29213 для соединения 3 – 125 мкг/мл, для соединения 4 – 62,5 мкг/мл, МПК относительно E.coli 25922 для соединений 3 – 62,5 мкг/мл, для соединения 4 – 31,2 мкг/мл, МПК относительно P.aeruginosa 27853 для соединения 3 – более 250 мкг/мл, для соединения 4 – 62,5 мкг/мл.
Таким образом, исследуемые соединения 3, 4 обладают способностью подавлять рост эталонных штаммов S. aureus 29213, E. coli 259213, а соединение 4 также в отношении P.aeruginosa 27853.
Результаты исследований противомикробной активности соединений 3, 4 диско-диффузионным методом приведены в таблице 2.
Таблица 2
Исследование противомикробной активности исследуемых соединений 3, 4 относительно тест-штаммов микроорганизмов диско-диффузионным методом
|
Тест-штамм Степень активности |
Контроль |
Соединение 3 |
Соединение 4 |
Диоксидин |
|
Staphylococcus aureus 906 |
0 |
++* |
++* |
++* |
|
Streptococcus pyogenes 1238 |
0 |
++* |
++* |
++* |
|
Enterococcus faecalis 2919 АТСС |
0 |
+ |
+ |
+ |
|
Escherichia coli М17 штамм |
0 |
++* |
++* |
+ |
|
Salmonella enteritidis 5765 ATСС |
0 |
+ |
+/- |
++* |
|
Shigella sonnei S-форма 20 |
0 |
+ |
+ |
++* |
|
Citrobacter freundii 101/57 |
0 |
+ |
+ |
+++* |
|
Klebsiella pneumoniaе 9172 |
0 |
++* |
+ |
+++* |
|
Proteus vulgaris 222 |
0 |
+ |
++* |
+++* |
|
Pseudomonas aeruginosa 453 |
0 |
+ |
+ |
++* |
|
Bacillus cereus 96 |
0 |
++* |
+++* |
+++* |
Примечание: * - отличие от контроля статистически достоверно при Р<0,05;
Диаметр зоны задержки роста, мм Степень активности вещества
более 25 высокая активность (+++)
16-25 активное (++)
10-15 малоактивное (+)
менее 10 и полное отсутствие неактивное (+/-, 0)
В контрольном эксперименте диски пропитывали дистиллированной водой в 100 % случаев наблюдался сплошной рост исследуемых микроорганизмов.
Препарат сравнения диокидин проявил высокую активность относительно тест-штаммов C. freundii 101/57, K. pneumoniaе 9172, P. vulgaris 222 и B. cereus 96 (Р≤0,05). Также чувствительны к препарату сравнения оказались S. aureus 906, S. pyogenes 1238, S. enteritidis 5765 ATСС, S. sonnei S-форма 20, P. aeruginosa 453 (Р≤0,05). На фоне применения диоксидина значимой задержки роста E. coli М17, E. faecalis 2919 АТСС не наблюдалось.
Соединение 3 оказалось активным относительно S. aureus 906, S. pyogenes 1238, E. coli М17, K. pneumoniaе 9172, B. cereus 96 (Р≤0,05), соединение 4 – относительно Streptococcus pyogenes 1238, Escherichia coli М17, Staphylococcus aureus 906, Proteus vulgaris 222 (Р≤0,05). Высокую чувствительность к соединению 4 показал B. cereus 96 (Р≤0,05).
Однако амид 3 оказался малоактивен в отношении E. faecalis 2919 АТСС, S. enteritidis 5765 ATСС, S. sonnei S-форма 20, C. freundii 101/57, P.s vulgaris 222, P. aeruginosa 453, амид 4 – в отношении S. sonnei S-форма 20, E. faecalis 2919 АТСС, C. freundii 101/57, P. aeruginosa 453 и K. pneumoniaе 9172.
Полученные данные свидетельствуют о наличие противомикробной активности амидов 3, 4 в отношении тест-штаммов грамотрицательных и грамположительных микроорганизмов.
Необходимо отметить, что исследованные нами амиды 3, 4 были получены впервые и ранее не были описаны в литературе. Данные соединения синтезированы в ходе изучения реакций 6-амино-5-метил-2-фенил-, 6-амино-1,5-диметил-2-фенил-индолов (1, 2) с этиловым эфиром трифторацетоуксусной кислоты, при этом было установлено неоднозначное их протекание (схема 1).
Так 5-метил-2-фенил-6-аминоиндол при кипячении с кетоэфиром в абсолютном бензоле дает циклический амид 3, в то время как 6-амино-1,5-диметил-2-фенилиндол в таких же условиях превращается в нециклический амид 4.
Схема 1
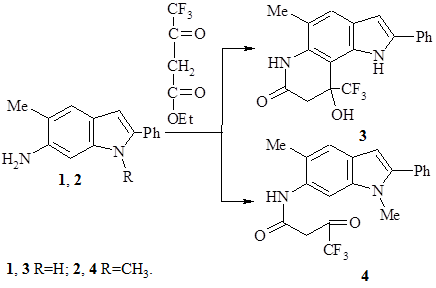
В пользу структуры 3 свидетельствуют данные ЯМР 1Н. В алифатической части спектра структуры 3 появляются в виде синглета протоны метильной группы, два дублета неравноценных метиленовых протонов. Ароматические протоны (β-пиррольный, бензольного кольца) проявляются в виде двух синглетов, фенильной группы – в виде двух триплетов и дублета. В области слабых полей имеются сигналы двух N–H протонов. Масс-спектр подтверждает молекулярную массу (M=360) предположительной структуры 3. Самым интенсивным пиком в масс-спектральном распаде является сигнал фрагментного иона с m/z 291, соответствующий потере молекулярным ионом радикала CF3, приводящей к стабильной протонированной пирроло[2,3-f]хинолоновой системе, что так же подтверждает цикличность структуры 3.
Однозначное протекание реакции конденсации за счет сложноэфирной группы β-кетоэфира подтверждается отсутствием сигналов протонов этоксигруппы в спектрах ЯМР 1Н, как для соединения 3, так и 4. К сожалению, картина спектра соединения 4 довольно сложна, что, по-видимому, объясняется наличием в растворе DMSО-d6 минимум трех таутомерных форм. Теоретические спектры каждой из предполагаемых структур отличается друг от друга. Поэтому полученный экспериментально спектр можно считать суммарным для предполагаемых таутомерных форм. Масс-спектр содержит молекулярный пик с m/z 374 низкой интенсивности, что свидетельствует в пользу нециклической структуры амида 4. Одним из основных направлений масс-спектрального распада является потеря M+ молекулы трифторбутендиона с образованием интенсивного сигнала иона аминоиндола m/z 236/
Заключение
Изучение противомикробной активности 9-гидрокси-5-метил-2-фенил-9-(трифторметил)-1,6,8,9-тетрагидропирроло-[2,3-f]хинолин-7-она (3) и N-(1,5-диметил-2-фенил-1Н-индол-6-ил)-4,4,4-трифторо-3-оксобутанамида (4) показало у них наличие противомикробного действия в отношении тест-штаммов грамотрицательных и грамположительных микроорганизмов.
Исследованные амиды 3, 4, впервые получены соответственно из 6-амино-1,5-диметил-2-фенил-, 6-амино-5-метил-2-фенилиндолов в реакциях с этиловым эфиром трифторацетоуксусной кислоты. На основании спектральных характеристик, полученные соединения идентифицированы как амиды, то есть реакции реализуются за счет аминогруппы аминоиндолаиндола и сложноэфирной функции кетоэфиров. При этом амиду 3 приписана циклическая структура. Невозможность образования циклического амида в случае амина 2 следует объяснить стерическими требованиями N-метильной группы. Пространственные требования пери-заместителей при образовании такого рода ангулярных структур наблюдалось и ранее [7].
Работа проводилась в рамках программы «Участник молодежного научно-инновационного конкурса» («УМНИК») при финансовой поддержке Фонда содействия развитию малых форм предприятий в научно-технической сфере (проект «Синтез азотсодержащих гетероциклических соединений и изучение возможности их применения в борьбе с инфекционными заболеваниями»).Рецензенты:
Инчина В. И., д.м.н., профессор, зав. кафедрой фармакологии и клинической фармакологии с курсом фармацевтической технологии Мордовского государственного университета имени Н. П. Огарева, г. Саранск;
Танасейчук Б. С., д.х.н., профессор, профессор кафедры органической химии Мордовского государственного университета имени Н. П. Огарева, г. Саранск.



