Распространенность метаболического синдрома (МС) в трудоспособной популяции составляет в среднем 25%. Синдром инсулинорезистентности является основой развития сахарного диабета 2-го типа и сердечно-сосудистых заболеваний (ССЗ) [1]. Кроме того, имеются данные, что МС негативно влияет на функцию почек, повышая риск возникновения хронической болезни почек (ХБП) в 1,6 раза [4].
Интегральным маркером кардиоренальных взаимоотношений является микроальбуминурия (МАУ), наличие которой указывает в том числе и на нарушенную функцию эндотелия [5]. Дисфункция эндотелия доказана при различных составляющих МС и может быть одним из его компонентов [2].
Одним из признанных биомаркеров дисфункции эндотелия является васкулоэндотелиальный фактор роста (ВЭФ), который активируется при формировании атеросклероза, гипертонической болезни, сахарного диабета 2-го типа [3]. В ряде работ было показано, что ВЭФ является ранним маркером повреждения почек у больных гипертонической болезнью (ГБ) [6].
Таким образом, вопрос ранней диагностики повреждения почек у больных МС весьма актуален, а использование маркера эндотелиальной дисфункции для этого процесса не изучено.
Цель исследования
Оценить возможность использования ВЭФ для ранней диагностики субклинического повреждения почек и эндотелиальной дисфункции у больных МС.
Материалы и методы
Группу обследования составили 40 пациентов с МС (критерии IDF, 2005) в возрасте от 25 до 55 лет, без органического повреждения почек в анамнезе и патологических изменений в общем анализе мочи, креатинина, без ультразвуковых признаков анатомических и структурных изменений почек. Пациенты ранее не получали гипотензивную терапию и статины.
В исследование не включали пациентов с вторичными формами АГ, больных с АГ III степени, сахарным диабетом (СД), воспалительными заболеваниями миокарда, системными заболеваниями соединительной ткани, онкологическими заболеваниями.
Группу сравнения составили 15 здоровых добровольцев (средний возраст 39,4±5,3 года; р<0,05).
Всем было проведено общеклиническое и лабораторное обследование. Уровни липидов, глюкозы плазмы крови, креатинина, мочевой кислоты, трансаминаз, билирубина определяли стандартными биохимическими методами. Индекс массы тела (ИМТ) рассчитывали по формуле Кетле: масса тела (кг)/рост (м²). Индекс инсулинорезистентности рассчитывался в малой модели гомеостаза (IR-HOMA). СКФ рассчитывали по формуле CKD-EPI мл/мин/1,73 м2. Степень снижения СКФ оценивали в соответствии с национальными рекомендациями 2012 г. [7].
Концентрацию изучаемых маркеров определяли в утренней порции мочи. Уровни ВЭФ в крови и моче, МАУ определяли методом иммуноферментного анализа (ИФА) с использованием фотометра «Stat-Fax» («Awareness Technology Inc.», США) и соответствующих наборов реагентов ЗАО «Вектор-Бест» (Новосибирск), «ELISA Micro-Albumin) производство Orgentec, Германия.
При статистической обработке данных использовали программу «Statistica 7.0 Rus». Оценивая данные с нормальным распределением, использовали (среднее, стандартную ошибку среднего), t-критерий Стьюдента. Данные с ненормальным распределением представлены в виде медианы и в виде интерквартильного интервала [25;75]. Для сравнения несвязанных выборок по количественным показателям использовали непараметрический критерий Манна—Уитни. Различия между выборками считали достоверными при значении для р<0,05. Связь признаков оценивали при помощи регрессивного анализа с определением коэффициента ранговой корреляции Спирмена, связь между значениями оценивали как сильную при R >|0,7|, средней силы при R от|0,3| до |0,7|, слабую при R< |0,3|.
Результаты
Сравниваемые группы не различались по возрасту (табл. 1). Отягощенная наследственность по сердечно-сосудистым заболеваниям (ССЗ) была выявлена у всех пациентов основной группы. Дислипидемия с гипертриглицеридемией присутствовала у 90%, низкий уровень ХСЛПВП — в 31%, а гипергликемия (без диагноза сахарного диабета) — у 68,5 % пациентов, что проявилось достоверным отличием от здоровых лиц. Средний стаж АГ оказался 4,1±2,5 года.
Таблица 1
Показатели больных метаболическим синдромом в сравнении с группой здоровых лиц (М ± SD).
|
Параметры (единицы) |
Группа МС (n=40) |
Здоровые (n=15) |
р |
|
Возраст (годы) |
42,3±8,3 |
39,4±5,3 |
0,7 |
|
ОТ (см) |
113,2±11 |
80,7±11 |
0,0001 |
|
ИМТ (кг/м²) |
38,0±10 |
27±1,3 |
0,00001 |
|
САД (мм рт. ст.) |
147,9±7,1 |
128,3±7,2 |
0,0001 |
|
ДАД (мм рт. ст.) |
98,8±5,0 |
78,5±5,3 |
0,0001 |
|
глюкоза (ммоль/л) |
5,8±0,8 |
4,21±0,5 |
0,0001 |
|
ХС (ммоль/л) |
5,9±0,9 |
4±0,7 |
0,004 |
|
ЛПНП (ммоль/л) |
3,62±0,7 |
2,43±0,4 |
0,03 |
|
ЛПВП (ммоль/л) |
1,31±0,3 |
1,4±0,1 |
0,3 |
|
ТГ (ммоль/л) |
2,33±1,1 |
0,57±0,11 |
0,001 |
|
креатинин (мкмоль/л) |
78,6±12,5 |
66,0±10,1 |
0,01 |
|
мочевая кислота (ммоль/л) |
391,4±45,4 |
241,5±86,1 |
0,009 |
|
СКФ мл/мин/1,73 кв.м. |
88,5±5,8 |
112,7±7,6 |
0,001 |
Примечание: АГ — артериальная гипертензия; ОТ — объем талии; ИМТ — индекс массы тела; САД — систолическое артериальное давление; ДАД — диастолическое артериальное давление; ХС — общий холестерин; ЛПНП – липопротеиды низкой плотности; ЛПВП — липопротеиды высокой плотности; ТГ — триглицериды; СКФ — скорость клубочковой фильтрации; SD (standard deviation) — стандартное отклонение; р – достоверность отличий в сравниваемых группах.
В группе МС было выявлено незначительное снижение СКФ (рис. 1).
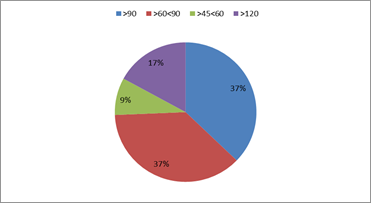
Рис. 1. Распределение пациентов по уровню СКФ мл/мин/1,73м²
Около половины больных МС с нормальным уровнем креатинина и протеинурии имели СКФ ниже оптимального. Значительное увеличение СКФ, равно как и ее снижение, было отмечено у больных с ожирением 3-й степени. Установлена отрицательная связь расчетной СКФ с уровнем ДАД (r=–0,4; р=0,04).
Была установлена прямая достоверная корреляция между суррогатным маркером инсулинорезистентности — величиной окружности талии (ОТ) и уровнем ДАД (r=0,43; р=0,03), мочевой кислоты (r=0,5; р=0,04), ТГ (r=0,36; р=0,03), ЛПОНП (r=0,5; р=0,04).
В группе больных МС была установлена достоверная корреляция уровня креатинина с общим холестерином (r=0,42; р=0,045), ЛПОНП (r=0,5; р=0,04) и мочевой кислоты (r=0,48; р=0,03).
Уровни маркеров эндотелиальной дисфункции и почечного повреждения – МАУ, ВЭФ — были значимо выше в группе МС (табл. 2).
Таблица 2
Концентрация ВЭФ и МАУ в группах
|
Показатель, единица измерения |
Значение медианы (25; 75% перцентиль); [Min- и Max- величины показателя] |
||
|
Группа МС (n = 38) |
контроль (n = 15) |
р |
|
|
Микроальбумин мг/мл |
25,8 (11,7; 34,0); [8,6; 56,5] |
9,4 (5,4;13,2); [1,4; 20,0] |
0,001 |
|
ВЭФ, пг/мл (моча) |
79,0 (28; 96,2); [5,0; 342] |
15,8 (9,1; 21,7); [02,1; 46,4] |
0,0001 |
|
ВЭФ, пг/мл (кровь) |
91 (76-270); [0-441] |
75 (0-96); [0-129] |
0,04 |
Примечание: МС — метаболический синдром; ВЭФ — васкулоэндотелиальный фактор роста
Уровни ВЭФ крови и мочи в группе МС были достоверно выше, чем в контрольной группе. Корреляции ВЭФ крови и мочи не было получено.
Была установлена прямая корреляция высокой степени между уровнем ВЭФ крови и общим холестерином (r=0,74; р=0,02), креатинином (r=0,67; р=0,001), IR-HOMA (r=0,36; р=0,04), ИМТ (r=0,4; р=0,04), уровнем ДАД (r=0,38; р=0,04), уровнем САД (r=0,6; р=0,02), МАУ (r=0,73; р=0,02) и отрицательная корреляция ВЭФ и СКФ (r=–0,7; р=0,02).
Также была установлена прямая связь между уровнем ВЭФ мочи и САД (r=0,49; р=0,04), МАУ (r=0,47; р=0,04), мочевой кислотой (r=0,49; р=0,04) и отрицательная с СКФ (r=–0,46; р=0,03).
Патологический уровень МАУ (>30 мг/мл) был установлен у 31,6% пациентов, 44,7% имели повышенный уровень МАУ (10–29 мг/мл).
Нами была установлена положительная корреляция величины МАУ с уровнем ДАД (r=0,7; р=0,02), уровнем креатинина (r=0,42; р=0,03), общего холестерина (r=0,41; Р=0,04) и отрицательная со значением СКФ (r=-0,5; р=0,03).
Обсуждение
На сегодняшний день СКФ рассматривают не только как показатель повреждения почек, но и как фактор риска неблагоприятных исходов у лиц с сердечно-сосудистыми заболеваниями и без них. В ряде работ было показано, что при снижении СКФ на 5 мл/мин/1,73 м2 риск сердечно-сосудистой смертности возрастает на 26%, а снижение СКФ с 90 до 60 мл/мин/1,73 м2 увеличивает ее в 4 раза. Причем связь снижения СКФ с исходами сердечно-сосудистых заболеваний не зависела от наличия АГ, СД [8]. В нашем исследовании незначительное снижение СКФ было выявлено у 37% пациентов, умеренное снижение СКФ — у 8,6%, меньший процент пациентов со сниженной СКФ в нашем исследовании можно объяснить более молодой группой (средний возраст 49 лет), небольшим стажем АГ (2–4 года).
Полученные изменения СКФ в отсутствие заболеваний почек в анамнезе и выявление четкой связи между показателями фильтрации, лабораторными проявлениями дисфункции эндотелия и уровня АД не только отражают начальные проявления нефропатии у больных МС, но и подтверждают повышенный риск сосудистых исходов.
Современные данные трактуют МАУ как показатель ранней почечной дисфункции, генерализованного поражения микрососудистого русла и доказанный маркер суммарного сердечно-сосудистого риска [2]. В среднем по данным литературы МАУ выявляется в 30–40% случаев АГ (до 72%), что, вероятно, связано с длительностью и тяжестью заболевания [2, 5]. Исследования АГ 1–2-й степени показали, что частота МАУ у данной категории больных составляет в среднем 12–22%, однако сочетание с ожирением увеличивает частоту МАУ до 30–40% [1, 2, 5]. В нашем исследовании МАУ была выявлена у 31,6% больных, и ее уровень сопряжен со снижением СКФ, что соответствует данным литературы.
Традиционное мнение о повышении уровня ВЭФ в ответ на гипоксию и активацию ангиогенеза подтверждается и данными нашего исследования [3]. У пациентов МС выявлено значительное повышение уровня ВЭФ крови и мочи по сравнению с контрольной группой. Увеличение содержания ВЭФ крови по мере роста ИМТ может быть связано со стимуляцией выделения цитокинов, в том числе и ВЭФ, под действием высокого уровня лептина, характеризующего степень ожирения [3].
Нами установлена прямая корреляционная связь между уровнем ВЭФ и индексом HOMA, отражающая зависимость инсулинорезистентности и эндотелиальной дисфункции. Существуют данные, подтверждающие значение ВЭФ как чувствительного предиктора развития сахарного диабета 2-го типа [9].
В нашем исследовании определяется значительное повышение уровня ВЭФ крови у молодых пациентов с малым стажем АГ. Также установлена корреляция уровня ВЭФ САД и ДАД, что подтверждает наличие дисфункции эндотелия даже у пациентов с небольшим стажем и невысокой степенью АГ [6, 10]. Следовательно, повышенный уровень ВЭФ крови в группе пациентов МС отражает наличие эндотелиальной дисфункции, связанной со степенью ожирения, инслинорезистентности и уровнем АД. Вероятно, мы можем рассматривать ВЭФ как интегральный показатель дисфункции эндотелия при множественных факторах риска сердечно-сосудистых заболеваний.
Ряд исследований показал, что связующим звеном между МАУ и сердечно-сосудистым риском может быть избыточная продукция ВЭФ, который не только повышает проницаемость сосудистой стенки, способствуя геморрагическим и атеросклеротическим процессам, но и увеличивает проницаемость клубочкового фильтра для альбумина [6, 10]. Было показано, что у больных мягкой формой АГ маркером раннего почечного повреждения может являться ВЭФ, причем была установлена прямая корреляция между величиной МАУ и уровнем ВЭФ в моче. Полученные данные отражают как наличие эндотелиальной дисфункции, так и активацию механизмов фиброгенеза, которые являются звеньями процессов ремоделирования микрососудистого русла почки при гипертонической нефропатии [6]. В нашем исследовании уровень ВЭФ мочи был достоверно выше в группе больных, нами также выявлена прямая корреляция МАУ и ВЭФ. Кроме того, была установлена отрицательная связь ВЭФ и СКФ, что также подтверждает то, что ВЭФ маркирует повреждение клубочка.
Выводы
1. Васкулоэндотелиальный фактор крови у пациентов с МС может быть интегральным маркером эндотелиальной дисфункции, связанным с основными компонентами синдрома инсулинорезистентности.
2. У пациентов с МС, не имеющих клинико-лабораторных признаков поражения почек, повышение МАУ и ВЭФ крови и мочи может свидетельствовать о субклинической почечной дисфункции.
Работа выполнена при поддержке ГРАНТа РНФ № 14-15-00809.
Рецензенты:
Завражных Л.А., д.м.н., главный врач ЗАО «Курорт Усть-Качка», г. Пермь;
Хлынова О.В., д.м.н., профессор кафедры госпитальной терапии ГБОУ ВПО ПГМУ им. ак. Е.А. Вагнера Минздрава России, г. Пермь.



