Тканевая инженерия представляет собой совершенно новую концепцию для восстановления, регенерации тканей и трансплантации органов, предлагает инновационный подход для восстановления поврежденных органов и тканей [4, 5]. Неспособность природных материалов полностью воспроизводить сложную структуру межклеточного матрикса привела к необходимости использовать децеллюляризированные естественные внеклеточные матриксы, полученные от доноров, либо матриксы, изготовленные из полимерных материалов и полностью воспроизводящие структуру нативного органа. Создание подходящего каркаса биоинженерного органа требует: во-первых, воссоздания структуры, сходной с нативной; во-вторых, развития сосудистой сети, способной обеспечить адекватную перфузию тканей; в-третьих, необходимо, чтобы клетки, используемые при рецеллюляризации, были способны к дифференцировке во все паренхиматозные и сосудистые клеточные элементы органа; в-четвертых, должна иметься возможность управления микроокружением клеток для воздействия на их функции; в-пятых, необходимо управлять дифференцировкой и созреванием клеток in vitro [5]. С учетом того факта, что реконструктивные операции при заболеваниях пищевода очень сложны, связаны со значительным количеством послеоперационных осложнений [7], а также высокой летальностью, необходимостью повторных операций с целью бужирования на фоне возникающих стриктур, создание тканеинженерного органа для замены поврежденного или отсутствующего является весьма перспективным. Основной целью данного исследования является получение децеллюляризированного матрикса пищевода низших приматов детергентно-энзиматическим методом, выполняемым путем перфузии децеллюляризирующими растворами с последующей иммуноморфологической оценкой сохранности внеклеточного матрикса (ВКМ) и отсутствия антигенности.
Материал и методы
Для создания децеллюляризированного матрикса тканеинженерного пищевода использовали органы 2 самцов макаки-резус (Macaca mulatta). Все манипуляции с животными осуществляли в соответствии с правилами проведения исследований с вовлечением экспериментальных животных (протокол локального этического комитета № 30/1). Материал был получен в условиях операционной ГБУЗ «Научно-исследовательский институт – краевая клиническая больница № 1 имени профессора С.В. Очаповского» министерства здравоохранения Краснодарского края. Затем пищевод транспортировали в лабораторию в охлажденном растворе PBS -/- (Gibco, Англия) при температуре +4°С. Время доставки составило не более 2 ч. В стерильных условиях с помощью пинцета и ножниц пищевод был выделен из окружающей соединительной ткани. Один орган был использован для проведения децеллюляризации, второй являлся нативным контролем. Краниальная и каудальная части пищевода были канюлированы пластиковыми катетерами в соответствии с их диаметром и фиксированы в специализированном биореакторе ORCA (HarvardApparatus, США). Децеллюляризацию пищевода низшего примата выполняли детергент-энзиматическим методом с проведением 2 циклов обработки стерильными растворами комнатой температуры: деионизированной водой – 1 ч; дезоксихолатом натрия 4%-ным + 2 mM раствором ЭДТА 1 ч; PBS -/- – 10 мин; свиной панкреатической ДНКазой-I 2000 ЕД /200 мл PBS +/+ – 1 ч ), PBS -/- 200 мл – 18 ч. Перфузию осуществлялисо скоростью 150 мл/мин.
Полученные образцы нативного и децеллюляризированного пищевода фиксировали в 10%-ном нейтральном забуференном формалине, дегидратировали и заключали в парафин по стандартной методике. С помощью микротома получали срезы толщиной 5 мкм. Для общегистологической оценки препаратов проводили окраску срезов гематоксилином и эозином (Histolab, Швеция). Для проведения иммуногистохимического анализа в качестве первичных были выбраны поликлональные антитела к коллагену I типа (ab34710, Abcam, Англия), коллагену IV типа (ab6586, Abcam, Англия), ламинину (ab11575, Abcam, Англия), фибронектину (ab2413, Abcam, Англия), тропомиозину (ab133292, Abcam, Англия), панцитокератину (ab7753, Abcam, Англия). Препараты дополнительно докрашивались гематоксилином. Изучение микропрепаратов проводилось на микроскопе Olympus BX51 (Япония).
Количественную оценку содержания ДНК в нативных и децеллюляризированных органах выполняли по стандартным протоколам производителя (Dneasy Bloodand Tissue Kit, Qiagen, Швеция). Анализ результатов проводили количественным методом на спектрофотометре BioDrop µLITE (Biochrom, Великобритания).
Статистическую обработку полученных данных осуществляли методами вариационной статистики на персональном компьютере. Анализ выборок производили с использованием программы GraphPadPrism 5 (GraphPadSoftware, США).
Результаты и их обсуждение
Для проведения децеллюляризации пищевода нами был использован детергент-энзиматический метод, как было показано в предыдущих исследованиях, в полной мере позволяющий удалять клетки из нативных тканей, но оказывающий щадящее воздействие на компоненты внеклеточного матрикса [1,2,3,6]. Перфузия пищевода децеллюляризирующими агентами приводила к тому, что орган в процессе проведения процедуры приобретал молочно-белую окраску, характерную для ацеллюлярных тканей, его просвет становился более широким за счет снижения эластичности ткани, характерной для нативного органа.
При обзорном окрашивании тканей пищевода гематоксилином и эозином не было выявлено сохранных клеток и клеточных ядер, в то же время сохранялась гистоархитектоника, свойственная нативной ткани: микроскопически выделяли эпителиальный, подслизистый и мышечный слои, состоящие соответственно из денуклеаризированных эпителиальных и мышечных клеток, эозинофильных волокон рыхлой волокнистой соединительной ткани. Оставались сохранными упорядоченная структура и преимущественно параллельное расположение коллагеновых волокон в матриксе. Отчетливо визуализировались неизмененные базальные мембраны сосудов. Набухания либо иных патологических изменений структуры, архитектоники, ориентации волокон, тинкториальных свойств соединительной ткани обнаружено не было (рис. 1).
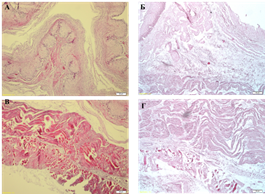
Рис. 1. Нативный (А, В) и децеллюляризированный (Б, Г) пищевод низшего примата. Гематоксилин и эозин. Увеличение: об. х10, ок. х10 (А, Б), об. х40, ок. х10 (В, Г)
Данные окрашивания гематоксилином и эозином не давали полного представления о составе и строении полученного матрикса, а также о качестве проведенной децеллюляризации. Так как при световой микроскопии препаратов децеллюляризированного пищевода изменений во внеклеточном матриксе не было выявлено, потребовалось изучение его белкового состава до и после проведения децеллюляризации. Иммуногистохимическая реакция с антителами к белкам внеклеточного матрикса проходила как в испытуемых образцах, так и в контролях.
В нативном пищеводе были определены основные белки внеклеточного матрикса ‒ коллаген I типа, коллаген IV типа, ламинин, фибронектин (рис. 2-3). Указанные белки в нативной ткани преимущественно локализовались в составе базальной мембраны эпителия и сосудах, а также в составе рыхлой волокнистой соединительной ткани, находящейся в мышечных слоях пищевода и адвентиции. В децеллюляризированной ткани пищевода низшего примата сохранялась исходная локализация данных белков внеклеточного матрикса.
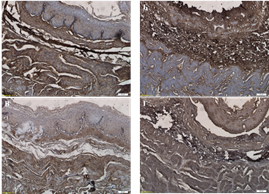
Рис. 2. Содержание коллагена I типа (А, Б) и IV типа (В, Г) во внеклеточном матриксе нативного (А, В) и децеллюляризированного (Б, Г) пищевода низшего примата. Иммуногистохимическое окрашивание. Увеличение: об. х10, ок. х10
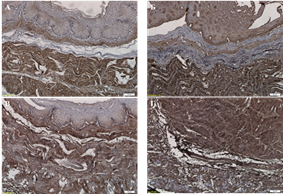
Рис. 3. Содержание ламинина (А, Б) и фибронектина (В, Г) во внеклеточном матриксе нативного (А, В) и децеллюляризированного (Б, Г) пищевода низшего примата. Иммуногистохимическое окрашивание. Увеличение: об. х10, ок. х10
В качестве маркера мышечной ткани использовали выявление белка тропомиозина. В нативном пищеводе тропомиозин выявлялся как во внутреннем циркулярном мышечном слое, так и в наружном продольном, слои были разделены между собой тонкой прослойкой межмышечной рыхлой волокнистой соединительной ткани. В децеллюляризированной ткани тропомиозин во внутреннем мышечном слое выявлен не был, в то время как в наружном была обнаружена экспрессия указанного белка (рис. 4 А, Б).
Белок панцитокератин, являющийся элементом цитоскелета эпителиальных клеток, использовали в качестве маркера наличия их фрагментарных остатков при проведении иммуногистохимического исследования. Положительная экспрессия искомого антигена была выявлена как в нативной, так и в децеллюляризированной ткани (рис. 4 В, Г).
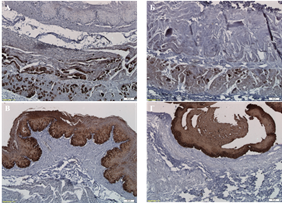
Рис. 4. Содержание тропомиозина (А, Б) и панцитокератина (В, Г) во внеклеточном матриксе нативного (А, В) и децеллюляризированного (Б, Г) пищевода низшего примата.. Иммуногистохимическое окрашивание. Увеличение: об. х10, ок. х10
Анализ содержания ДНК показал снижение количества ядерного материала в децеллюляризированном пищеводе до 29% от исходного уровня (293,59±27,09 нг/мг в нативном пищеводе и 75,49±7,46 нг/мг – в децеллюляризированном). Полученные результаты свидетельствовали об эффективности проведенной децеллюляризации, после которой матрикс был в значительной степени (p = 0,0011) очищен от ядерного материала.
В заключение хочется отметить, что результаты обзорных методов гистологического окрашивания тканей, а также данные иммуногистохимического анализа позволяют сделать вывод о том, что перфузионный детергент-энзиматический метод не позволяет полностью децеллюляризировать полый трубчатый орган, каким является пищевод, однако приводит к полной денуклеаризации ткани и существенному уменьшению содержания ДНК в ней. Таким образом, изучение возможностей и перспектив создания внеклеточного матрикса пищевода низших приматов необходимо продолжить, а также провести оптимизацию и модификацию протокола его децеллюляризации.
Работа выполнена при финансовой поддержке Российского научного фонда для проведения фундаментальных научных исследований и поисковых научных исследований международными научными группами (номер проекта 14-45-00018 от 15.10.2014 года).
Рецензенты:
Гуменюк С.Е., д.м.н., профессор, заведующий кафедрой хирургии педиатрического и стоматологического факультетов ГБОУ ВПО КубГМУ Минздрава России, ГБОУ ВПО КубГМУ Минздрава России, г. Краснодар.
Каде А.Х., д.м.н., профессор, заведующий кафедрой общей и клинической патофизиологии ГБОУ ВПО КубГМУ Минздрава России, ГБОУ ВПО КубГМУ Минздрава России, г. Краснодар.



