Распространенность ожирения носит характер эпидемии в развитых странах. По данным ВОЗ 2014 г. более 1,9 млрд взрослых людей в возрасте 18 лет и старше имеют избыточный вес, из них свыше 600 млн страдают ожирением.
Жировая ткань не только сосредотачивает основной запас энергетических субстратов организма, но и обладает эндокринной активностью. Выделяют два основных жировых депо: подкожное и висцеральное. В зависимости от топографического расположения жировая ткань имеет морфологические и физиологические особенности. При избыточной массе тела характер ее распределения влияет на развитие метаболических нарушений. Количество висцеральной жировой ткани является одним из важных прогностических факторов развития заболеваний, ассоциированных с ожирением [1].
Цель работы
Изучить морфометрические параметры мезентериальной (МЖТ), эпидидимальной (ЭЖТ), забрюшинной (ЗЖТ) и подкожной (ПЖТ) белой жировой ткани крыс при высокожировой диете.
Материал и методы
Исследования проводили на 10 белых крысах-самцах Wistar. Содержание и все манипуляции, которым подвергались животные во время карантина и исследования, соответствовали правилам лабораторной практики, утвержденным Приказом министра здравоохранения и социального развития от 23 августа 2010 г. № 708н «Об утверждении правил лабораторной практики», а также с соблюдением Конвенции по защите позвоночных животных, используемых для экспериментальных и других научных целей, принятой Европейским союзом в 1986 г., и Директивы 86/609 ЕЭС, основанной на тексте соглашения «Dr. RobertHubrecht, Current EU Legislation Controlling Animal Experiments».
Животные были разделены на 2 группы: 1-я (5 крыс) получала стандартный корм (доля жира в общей калорийности корма составила 11%) для лабораторных крыс — «ПроКорм» (ЗАО «БиоПро», г. Новосибирск) и воду ad libitum. Животные 2-й группы (5 крыс) в течение 18 недель находились на высокожировой диете (доля жира в общей калорийности корма составила 32%) и принимали воду ad libitum.
Животных выводили из эксперимента СО2-асфиксией.
Определялась масса тела крыс, методом диссекции [2] выделялась и взвешивалась на аналитических весах жировая ткань (мезентериальная, эпидидимальная, забрюшинная, подкожная), рассчитывалась ее удельная масса (масса жировой ткани на 100 г массы тела крысы). Для морфометрического исследования кусочки жировой ткани фиксировались в 10%-ном нейтральном забуференном формалине (Biovitrum, Россия), обезвоживались в изопропиловом спирте (Biovitrum, Россия) и заливались в парафин (Histomix, Россия) по методике Ю.А. Криволапова. На микротоме МЗП–01 (Техном, Россия) изготавливались срезы толщиной 5–7 мкм, которые монтировались на предметные стекла и окрашивались гематоксилином и эозином. Полученные микропрепараты просматривались в проходящем свете на микроскопе Биомед–3М (Россия), совмещенном с компьютером. Оцифрованные фотографии подвергались морфометрической обработке с использованием компьютерной программы ImageJ 1.46. Для каждой группы животных определялся средний размер 500 жировых клеток, оценивалось распределение клеток по размеру (% клеток малого (< 50 мкм), большого (50–100 мкм), крупного (100>мкм) размера).
Статистическую обработку данных проводили с использованием программного пакета SPSS 20.0 с использованием методов непараметрической статистики. Полученные результаты выражены в виде медианы (Ме), верхнего и нижнего квартилей (Q1–Q3). Различия считали достоверными при p <0,05.
Результаты и обсуждение
Ожирение у грызунов рассматривают как увеличение массы тела за счет жировых депо по сравнению с контрольной группой. Критерии оценки ожирения у животных включают такие показатели, как прирост массы тела, индекс массы тела и масса жировой ткани, при этом более чувствительным показателем является измерение общей массы жировой ткани [2].
В результате эксперимента установлено, что высокожировая диета у крыс приводит к увеличению массы тела животных на 25% (p<0,01) (табл. 1), что обусловлено ростом массы жировых депо, о чем свидетельствует повышение удельной массы жировой ткани в 3 раза (p<0,01). При этом удельная масса мезентериальной жировой ткани возрастала в 2,1 раза (p<0,01), эпидидимальной — в 1,6 раза (p<0,01), забрюшинной — в 3,5 раза (p<0,01), подкожной жировой ткани — в 5,5 раза (p<0,01) соответственно по сравнению с группой крыс, получавших стандартную диету.
Таблица 1
Масса тела и удельная масса мезентериальной, эпидидимальной, забрюшинной, подкожной жировой ткани крыс при стандартной и высокожировой диете, Me (Q ₁–Q₃)
|
Показатели Me (Q ₁–Q₃) |
Экспериментальные группы |
|
|
1.Стандартная диета (n=5) |
2.Высокожировая диета (n=5) |
|
|
Масса тела, г |
460 (440–480) |
577 (555–610) * |
|
удельная масса жировой ткани, г |
4,22(4,01–4,31) |
12,64(10,87–13,67)* |
|
удельная масса МЖТ, г |
1,07 (1,06–1,11) |
2,26 (2,08–2,26)* |
|
удельная масса ЭЖТ, г |
1,36(1,21–1,38) |
2,19(1,97–2,57)* |
|
удельная масса ЗЖТ, г |
0,98(0,978–1,05) |
3,39(2,98–3,58)* |
|
удельная масса ПЖТ, г |
0,88 (0,85–0,91) |
4,89 (3,59–5,16)* |
Примечание: n – число животных в группе; * — p₂₋₁<0,01
Известно, что у грызунов эпидидимальная жировая ткань доминирует (имеет большую массу) по сравнению с висцеральной жировой тканью других локализаций [6]. Это хорошо соотносится с полученными нами данными: у крыс, находившихся на стандартном питании, преобладала удельная масса эпидидимальной жировой ткани. При высокожировой диете увеличение жировых депо произошло за счет роста удельной массы подкожной и забрюшинной жировой ткани. Ранее показано, что подкожное жировое депо выступает как одно из основных резервуаров накопления жира и может являться защитным механизмом других тканей от липотоксичности [7].
Висцеральная жировая ткань у грызунов представлена мезентериальной (располагается по ходу кишечника), забрюшинной (располагается за почками) и эпидидимальной (располагается вдоль семенников) [2]. Жировые депо морфологически и биохимически отличаются. Мезентериальная жировая ткань наиболее метаболически активна: ей присущи высокая мобильность липидов, плотность сосудистой сети и интенсивный кровоток, преобладают адипоциты малого размера. Эпидидимальная жировая ткань имеет менее интенсивный метаболизм глюкозы и липидов, в ней преобладают адипоциты большого размера. Забрюшинная жировая ткань представлена адипоцитами среднего и большого размера. Подкожная жировая ткань (подкожное депо паховой области) имеет низкую интенсивность метаболизма глюкозы и липидов, адипоциты малого размера [2, 6].
Размер адипоцитов определяет метаболическую активность жировой ткани. Адипоциты гетерогенны по размеру в пределах одного жирового депо и могут быть разделены на малые (диаметром до 50 мкм), большие (диаметр от 50 до 100 мкм), крупные (диаметр более 100 мкм) [4]. Средний размер адипоцитов мезентериальной жировой ткани в группе животных, находившихся на высокожировой диете, был больше на 63% (p<0,005), эпидидимальной — на 19% (p<0,01), забрюшинной на 14% (p<0,01) и подкожной — на 13% (p<0,05) по сравнению с группой крыс, получавших стандартную диету (табл. 2).
Таблица 2
Средний размер адипоцитов мезентериальной, эпидидимальной, забрюшинной и подкожной жировой ткани крыс при стандартной и высокожировой диете, Me (Q ₁ - Q₃)
|
Показатели Me (Q ₁–Q₃) |
Экспериментальные группы |
|
|
1. Стандартная диета (n=5) |
2. Высокожировая диета (n=5) |
|
|
Средний размер адипоцитов МЖТ, мкм |
42 (37–47) |
68,7 (60,7–78)* |
|
Средний размер адипоцитов ЭЖТ, мкм |
122,8 (111,1–136,5) |
146,6 (130,1–162,4)** |
|
Средний размер адипоцитов ЗЖТ, мкм |
97,9 (89,4–106,5) |
111,8 (102,5–122,8)** |
|
Средний размер адипоцитов ПЖТ, мкм |
47,8 (43,1–54,3) |
54,1 (48,3–61,4)* |
Примечание: n – число животных в группе; * — p₂₋₁<0,005; ** — p₂₋₁<0,01
Изменение среднего размера адипоцитов может быть обусловлено двумя процессами: гипертрофией и гиперплазией клеток [3].
У животных, получавших стандартное питание, в мезентериальной жировой ткани преобладали клетки малого размера (до 50 мкм), в эпидидимальной — клетки крупных размеров (более 100 мкм), в забрюшинной — клетки большого размера (50–100 мкм), в подкожной — малого и большого размеров.
Высокожировая диета приводила к преобладанию в мезентериальной жировой ткани клеток большого размера (50–100 мкм), эпидидимальной и забрюшинной жировой ткани — клеток крупных размеров (более 100 мкм), в подкожной жировой ткани — малого и большого размеров (рис. 1, 2, 3,4).
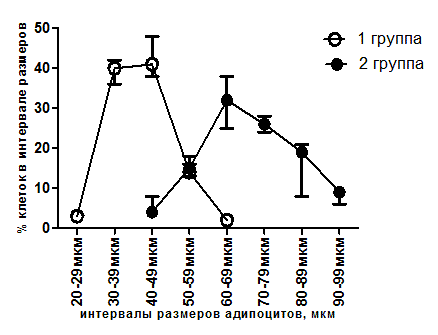
Рис. 1. Распределение адипоцитов мезентериальной жировой ткани крыс по размеру: 1 — стандартная диета (n=5); 2 — высокожировая диета (n=5)
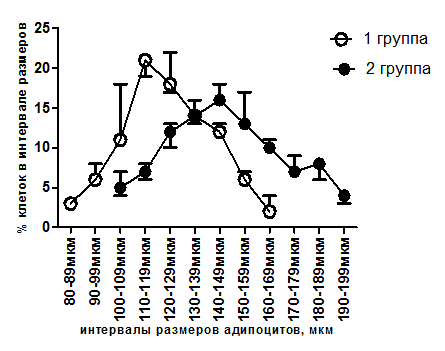
Рис. 2. Распределение адипоцитов эпидидимальной жировой ткани крыс по размеру: 1 — стандартная диета (n=5); 2 — высокожировая диета (n=5)
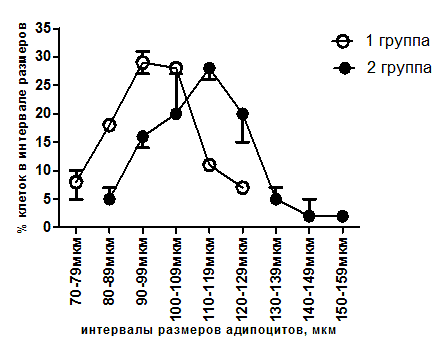
Рис. 3. Распределение адипоцитов забрюшинной жировой ткани крыс по размеру: 1 — стандартная диета (n=5); 2 — высокожировая диета (n=5)
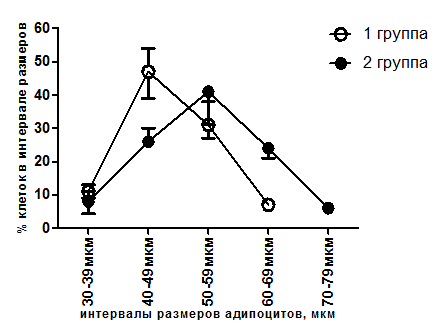
Рис. 4. Распределение адипоцитов подкожной жировой ткани крыс по размеру: 1 — стандартная диета (n=5); 2 — высокожировая диета (n=5)
Таким образом, увеличение удельной массы висцеральных жировых депо при высокожировой диете обусловлено гипертрофией жировых клеток, а подкожной жировой ткани — возможно, за счет гиперплазии (количество клеток ведь не считали).
Изменение массы жировой ткани у крыс с возрастом происходит за счет преимущественно гипертрофии клеток мезентериальной и эпидидимальной жировой ткани, в то время как забрюшинной и подкожной жировой ткани — за счет гиперплазии [3].
Увеличение размера клеток более 80–100 мкм приводит к снижению поглощения глюкозы, триацилглицеролов и чувствительности к инсулину [9]. Известно, что гипертрофированные клетки являются главным источником провоспалительных цитокинов и имеют ограниченную способность синтезировать адипонектин, являющийся мощным противовоспалительным адипокином и эндогенным сенсибилизатором инсулина [5]. В гипертрофированной жировой ткани снижается кровоток, инициирующий локальную гипоксию, и усиливается инфильтрация макрофагами, цитокины которых ингибируют адипогенез [8].
Обнаруженное нами менее выраженное увеличение среднего размера адипоцитов подкожной жировой ткани у животных, находившихся на высокожировой диете, по сравнению с жировой тканью висцеральных депо обусловлено преобладанием клеток малых размеров.
Таким образом, нарастание массы подкожной жировой ткани при высокожировой диете происходит за счет увеличения клеток малых размеров, которые согласно современным исследованиям защищают от накопления жира мышцы и печень и препятствуют развитию инсулинорезистентности [5].
Выводы
У крыс, находившихся на стандартной диете, преобладают удельная масса и средний размер адипоцитов эпидидимальной жировой ткани.
Высокожировая диета приводит к увеличению удельной массы всех видов жировой ткани с преобладанием подкожной. Увеличение удельной массы висцеральных жировых депо сопряжено с преобладанием адипоцитов крупных размеров.
В подкожной жировой ткани у крыс при высокожировой диете преобладают адипоциты малых размеров по сравнению с жировой тканью другой локализации.
Рецензенты:
Бушов Ю.В., д.б.н., профессор, заведующий кафедрой физиологии человека и животных, Томский государственный университет, г. Томск;
Ковалев И.В., д.м.н., профессор, профессор кафедры биофизики и функциональной диагностики, Сибирский государственный медицинский университет, г. Томск.



