Фундаментальным понятием в биологии является понятие о гомеостазе. Особую актуальность приобретает исследования механизмов поддержания тканевого гомеостаза организма в условиях интенсивной урбанизации окружающей среды и представляет собой центральную проблему биологии и медицины. При этом актуальным является изучение развития органов, которые непосредственно участвуют в поддержании гомеостаза организма [1; 6]. Печень, как один из таких органов, осуществляет межсистемную кооперацию в организме, а сложность структуры, полифункциональность, быстрота вовлечения в деструктивные и репаративные процессы – определяет интерес исследователей к сравнительному изучению закономерностей структурно-функциональной организации печени, анализу адаптационных перестроек, выявлению механизмов, обеспечивающих развитие организма в целом. Исследование процессов морфогенеза печени на различных критических периодах эмбриогенеза ведет к пониманию степени зрелости и функциональных возможностей органов и организма птиц эволюция которых контролируется человеком и проходила в разных направлениях, вследствие чего было получено огромное количество разнообразных форм – кросс-линий кур [7].
В связи с этим целью нашей работы является изучить соотношение путей программируемой клеточной гибели, регуляторов клеточного цикла и показателей пролиферации гепатоцитов в трех зонах печеночного ацинуса печени кур-бройлеров «РОСС-308» в раннем эмбриогенезе.
Материалы и методы. Для решения поставленных задач эксперимент поставлен на группе птиц - куры-бройлеры четырехлинейного кросса «РОСС-308» (родительские линии - породы корниш кросса ROSS 78F и ROSS 14M). Согласно литературным данным, 14 сутки эмбриогенеза, на которые проводился забор материала для исследований является критическим для гистации печени [6; 8]. Эксперимент поставлен в 2 повторности на 40 особях (20 особей служили контролем). Анализ соотношения путей программируемой клеточной гибели (ПКГ) и их регуляторов, пролиферативной активности гепатоцитов проводили иммуногистохимически, стрептавидин-биотиновым методом [9]. Показатели пролиферации гепатоцитов определяли с помощью выявления антител к белкам-маркерам PCNA (разведение 1:100, Novocastra). В дальнейшем проводился подсчет на 1000 гепатоцитов и PCNA-позитивных гепатоцитов и количества двуядерных форм (‰). Выявление соотношения путей ПКГ гепатоцитов проводили, используя маркеры различных программ ПКГ: апоптоза (смерть клетки по типу I), осуществляли с помощью антител к белкам-маркерам каспазы-3 СРР32 (разведение 1:100, Novocastra); аутофагии (смерть клетки по типу II), определяли с помощью антител к белку-маркеру начальной стадии аутофагии LC3А/B (разведение 1:200, Abcam). Анализ путей регуляции программ ПКГ осуществляли с помощью выявления антител к белкам-маркерам p53 (разведение 1:80, Novocastra) и bcl-2 (разведение 1:100, Novocastra). Для цитофотометрического исследования состояния хроматина и распределения гепатоцитов по стадиям клеточного цикла мазки печени фиксировали в метаноле, окрашивали по Фельгену в модификации G.Olson в реактиве Шиффа [3]. Обработку препаратов проводили на автоматизированном морфометрическом комплексе «Axioplan» («Carl Zeiss», Германия). Статистическую обработку полученных данных осуществляли с помощью пакета прикладных программ «STATISTICA-6». Различия считались значимыми при р=0,05. При проведении эксперимента руководствовались принципами гуманного отношения к животным в соответствии с Международными рекомендациями [4].
Результаты исследования. У кур-бройлеров на 14-е сутки эмбриогенеза трубчатое строение паренхимы печеночного ацинуса не определяется. В цитоплазме гепатоцитов наблюдается умеренно-выраженная мелкокапельная жировая вакуолизация (рис. 1 Д). Сосуды портального тракта с признаками полнокровия. В области сосудов портального тракта и центральных вен отмечаются очаги кроветворения. Эритроциты в большом количестве выявляются в паренхиме печеночного ацинуса, что свидетельствует о процессах эритроцитопоэза.
Преимущественная локализация двуядерных и PCNA-позитивных гепатоцитов отмечается в перипортальной и центролобулярной зоне, соответственно распределение показателей пролиферации гепатоцитов проявляет порто-венулярный градиент. В тоже время максимальное число двуядерных гепатоцитов выявлено и в области центральных вен (рис. 1 В).
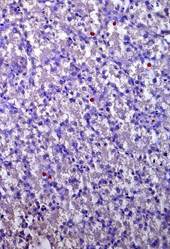
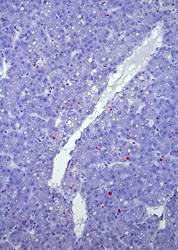
СРР32-позитивные гепатоциты в большем количестве локализованы в перипортальной и центролобулярной зонах ацинуса, а LC3A/B-позитивные - в центролобулярной (рис. 1 А. Б, Г). Преимущественная локализация р53- и bcl-2-позитивных гепатоциты отмечается в перипортальной зоне, соответственно распределение показателей носит порто-венулярный градиент.
Таким образом, на фоне высоких показателей р53- и bcl-2-позитивных гепатоцитов гибель гепатоцитов реализуется по пути апоптоза в перипортальной и центролобулярной зоне. Тогда как в перивенулярной зоне, где количество р53- и bcl-2-позитивных гепатоцитов наименьшее, реализуется программа аутофагии.
Необходимо отметить, что высокие показатели числа р53- и bcl-2-позитивных гепатоцитов и числа погибших гепатоцитов по пути апоптоза в области портального тракта и центролобулярной зоны соотносятся с наибольшим числом двуядерных и PCNA-позитивных гепатоцитов. Выявленные таким образом высокие показатели экспрессии белка р53 гепатоцитами не только регулируют реализацию путей ПКГ, но участвуют в регуляции процессов метаболизма и активности АОС [2]. В перивенулярной зоне активация программы аутофагии гепатоцитов реализуется на фоне наибольшего числа двуядерных форм гепатоцитов. Активация аутофагии в области центральных вен, по всей видимости, индуцируется недостатком питательных веществ, кислорода, который имеет место быть у птенцовых [11, 12, 13].
 А
А 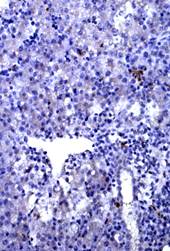 Б
Б 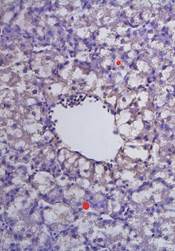 В
В
 Г
Г 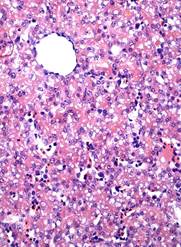 Д
Д
Рис. 1. Печень эмбрионов кур-бройлеров на 14 сутки развития. Увеличение ок10хоб20. Окрашивание антителами к СРР32 (А), антителами к LC3A/B (Б), антителами к PCNA (В). антителами к bcl-2 (Г). Протокол HIAR (Heat Induced Antigen Retrieval), стрептавидин-биотиновый метод (LSAB), хромоген АЭК. Окраска гематоксилин-эозин (Д)
 А
А 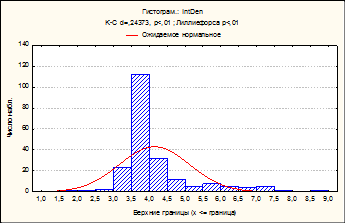 Б
Б
 Г
Г
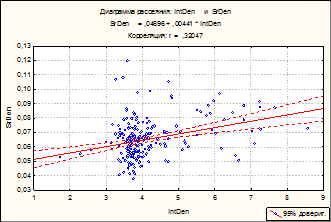
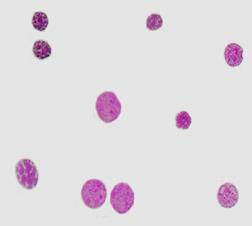
Рис. 2. Куры-бройлеры «РОСС-308». 14 сутки эмбрионального развития. Двумерное распределение ядер гепатоцитов по IntDen – интегральной оптической плотности ДНК и SrDen – средней оптической плотности ДНК (А). Гистограмма распределения популяции гепатоцитов по клеточному циклу. IntDen – интегральная оптическая плотность хроматина (Б). Многофакторный дисперсный анализ MANOVА. Ядра гепатоцитов. Окраска по Фельгену. Увеличение ок10хоб90. Гетерогенность топографии хроматина гепатоцитов (Г)
Согласно результатам цитофотометрии (рис. 2) на раннюю стадию эмбриогенеза выявленное большое количество гиподиплоидных гепатоцитов - 1,9%, сопровождается большим количеством изолированных участков гетерохроматина, вместе с тем 84% гепатоцитов находятся в стадии G0/G1 и 14% в активных фазах цикла пролиферации и полиплоидизации (S+G2+M).
Согласно литературным данным для ранней стадии эмбриогенеза птиц характерны дефицит парциального содержания кислорода, не сформированная система терморегуляции, толерантная стратегия метаболической адаптации [5]. Вышеперечисленные условия развития во многом определяют выявленные нами особенности в поддержании тканевого гомеостаза. Так, на клеточном уровне бóльшее количество погибших гепатоцитов определяется в центролобулярной зоне, при этом на фоне высоких показателей р53-позитивных гепатоцитов, гибель клеток в равной мере реализуется по I и II пути, о чем можно судить по количеству СРР32- и LC3A/B-позитивных гепатоцитов [13]. В области портального тракта выявленные низкие показатели апоптоза, по всей видимости, поддерживаются высоким уровнем экспрессии гепатоцитами антиапоптического белка bcl-2, который служит фактором выживания клетки, защищая ее от гибели, проявляя онкогенный эффект [10]. На фоне деструктивных процессов реализуются и процессы регенерации, так, в перипортальной зоне выявлены высокие показатели PCNA-позитивных гепатоцитов, и согласно цитофотометрии количество гепатоцитов в стадию S+G2+M составляет 14% от общего числа гепатоцитов.
Таким образом иммуногистохимически и цитофотометрически определены тканевые показатели гомеостаза, пролиферативные зоны печеночного ацинуса, за счет которых осуществляется компенсаторно-приспособительные реакции, определяющие поддержание и становление гомеостаза на изучаемые критические периоды онтогенеза.
Рецензенты:
Молдавская А.А., д.м.н., профессор кафедры анатомии человека ГОУ ВПО «Астраханская государственная медицинская академия», г. Астрахань;
Мкртчан О.З., д.б.н., профессор кафедры биологии и биологического образования ФГОБУ ВПО Омский государственный педагогический университет, г. Омск.



