Полихимиотерапия (ПХТ) на современном этапе развития детской онкологии является ведущим методом в составе комплексной терапии в детской онкологической практике. Интенсификация схем химиотерапии (увеличение доз, уменьшение интервалов между введениями) позволила значительно улучшить результаты лечения и, соответственно, повысить выживаемость в детской онкологической практике [2, 9].
Нужно отметить, что наряду с цитопатическим действием цитостатических агентов на опухолевые клетки повреждаются и здоровые ткани организма, нарушаются его гомеостаз, физиологическое взаимодействие органов и систем. Искусство проведения цитостатического лечения связано прежде всего не с формальным соблюдением режима введения химиопрепарата в организм больного, а с профилактикой и лечением острых и отсроченных осложнений химиотерапии, т.е. с искусством сопроводительного лечения [4]. При проведении длительной многокурсовой дозоинтенсивной ПХТ у детей встречается весь спектр осложнений: ургентные состояния (в том числе синдром острого лизиса опухолевых клеток, гиперлейкоцитоз и другие метаболические и эндокринные нарушения, кровотечения); миелодепрессия, чаще всего нейтропения и анемия; инфекционные осложнения, возникающие на фоне 100%-ной иммуносупрессии, в том числе фебрильная нейтропения, септические состояния [4, 8]. В настоящее время ведется активный поиск средств и лекарственных препаратов, позволяющих уменьшить частоту встречаемости вышеперечисленных осложнений, в том числе и осложнений, связанных с иммуносупрессией: инфекционных осложнений (вирусных, бактериальных, грибковых инфекций). Перспективным направлением в профилактике иммунной недостаточности и развитии инфекционных осложнений на фоне противоопухолевой химиотерапии является применение отечественного препарата полиоксидоний с преимущественным влиянием на моноцитарно-макрофагальное и нейтрофильное звено иммунной системы. Полиоксидоний с успехом используется в сопроводительной терапии химиолучевого лечения различных онкологических заболеваний, таких как рак молочной железы, рак толстой кишки, рак гортани, рак прямой кишки, и не оказывая влияния на клиническое течение и прогноз самого заболевания, улучшает тем не менее переносимость химиотерапии, нормализует лабораторные показатели, восстанавливает показатели иммунного статуса больного [5, 6, 7]. В частности, у детей известно применение полиоксидония в комплексном лечении лимфомы Ходжкина и лангергансово-клеточного гистиоцитоза [1, 3].
В нашей практике мы применяли иммунотропный препарат полиоксидоний в качестве сопроводительной терапии полихимиотерапии у детей с солидными злокачественными опухолями. Полиоксидоний назначался после окончания каждого курса полихимиотерапии подкожно в дозе 0,15 мг на 1 кг массы тела ребенка 1 раз в день в течение 5 дней.
Целью исследования явилось изучить эффективность применения полиоксидония в сопроводительной терапии комплексного лечения детей и подростков с солидными злокачественными опухолями.
Материалы и методы
Клиническим материалом для исследования послужили данные 50 детей и подростков в возрасте от 6 до 18 лет, проходивших лечение в отделении детской онкологии РНИОИ по поводу солидных злокачественных новообразований, за период с 2005 по 2011 гг. Больные были разделены на 2 группы: основная группа – 20 больных, которым наряду с полихимиотерапией проводили иммунокорригирующую терапию полиоксидонием, контрольная группа – 30 больных, которым проводилась полихимиотерапия без применения полиоксидония (таблица).
Распределение нозологических форм солидных опухолей у детей и подростков в исследуемых группах
|
Нозологические формы опухолей |
Количество больных (всего) (абс./%) |
|
|
Основная группа |
Контрольная группа |
|
|
Саркома Юинга |
3 (15%) |
10 (33,4%) |
|
Остеогенная саркома |
2 (10%) |
6 (20%) |
|
Герминогенные опухоли |
4 (20%) |
4 (13,3%) |
|
Нейробластома |
3 (15%) |
4 (13,3%) |
|
Рабдомиосаркома |
- |
3 (10%) |
|
Рак носоглотки |
7 (35%) |
3 (10%) |
|
Нефробластома |
1 (5%) |
- |
|
Всего: |
20 (100%) |
30 (100%) |
В основной группе, где применялся полиоксидоний, индукционная терапия проведена 14 больным (58 курсов), и на этапе консолидирующей терапии – 16 больным (54 курса). Полихимиотерапия без применения полиоксидония проводилась 27 больным на этапе индукционной терапии (94 курса), 26 больным – на этапе консолидирующей терапии (122 курса).
Всем детям и подросткам с солидными злокачественными новообразованиями результаты проведенной ПХТ оценивали по принятым в детской онкологии критериям – полный эффект (ПЭ); выраженный клинический эффект (ВКЭ); частичный клинический эффект (ЧЭ); стабилизация заболевания (СЗ); прогрессирование заболевания (ПЗ) [4]. Степень выраженности острых и подострых токсических эффектов от цитостатической терапии оценивали по модифицированной международной шкале Европейского общества онкологов-педиатров (SIOP).
Для оценки иммунного статуса производили забор крови для иммунологического исследования перед каждым курсом и на 10–14-й день от начала каждого курса химиотерапии. В качестве контроля использовали иммунологические показатели здоровых детей соответствующей возрастной группы. Фенотипирование лейкоцитов из образцов цельной крови выполняли по стандартной методике проточной цитометрии с использованием флюорохром-конъюгированных моноклональных антител. Анализ проводили на цитофлюорометрах BD Facs Cantoo II.
С целью оценки активности нейтрофильного звена иммунитета определяли интенсивность кислородозависимых реакций с помощью спонтанного и стимулированного латексом теста восстановления нитросинего тетразолия до диформозана (НСТ-теста), с вычислением индекса стимуляции нейтрофилов.
Результаты
В результате проведенной индукционной полихимиотерапии в контрольной группе выраженный клинический эффект достигнут у 7 пациентов (25,9%), в основной группе достигнут у 4 пациентов (28,5%). Частичный клинический эффект в контрольной группе получен при лечении 13 пациентов (48,6%), в основной группе частичного клинического эффекта удалось добиться у 7 пациентов (50%). Стабилизация в течении заболевания достигнута в контрольной группе у 5 (18,6%), в основной группе у 2 пациентов (14,3%). У 2 детей в контрольной группе отмечалось прогрессирование опухолевого процесса (7,4%) и в основной группе у 1 пациентки с эйстейзионейробластомой III стадии (7,1%). Полный клинический эффект по критериям SIOP на этапе индукционного лечения не был достигнут ни у одного пациента (рис. 1).
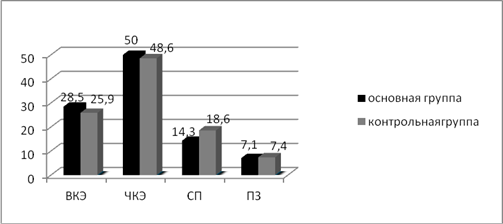
Рис. 1. Процентное соотношение эффективности индукционной терапии в исследуемых группах
Анализируя проведенную консолидирующую ПХТ (контрольная группа), необходимо отметить, что у 17 пациентов она была выполнена после радикального удаления опухоли или лучевой терапии. Полный клинический эффект после проведенной консолидирующей ПХТ имели 15 пациентов (57,7%), выраженный клинический эффект — 4 пациента (15,4%), стабилизация заболевания была у 4 пациентов (15,4%), прогрессия заболевания на этапе консолидирующей ПХТ и по ее окончании наступила у 3 пациентов (11,5%) (рис. 2).
В основной группе консолидирующую ПХТ с иммунокоррекцией в качестве адъювантного лечения после радикальной операции или лучевой терапии провели 9 больным. Полный клинический эффект отмечен у 11 больных (56,6%), выраженный клинический эффект — у 2 пациентов (12,5%). Стабилизация заболевания наблюдалась у 3 больных (18,7%), прогрессия заболевания наступила у 2 пациентов (12,5%). Анализируя приведенные выше данные, можно сказать, что достоверных отличий в непосредственных результатах между ПХТ и ПХТ с полиоксидонием не выявлено (рис. 2).
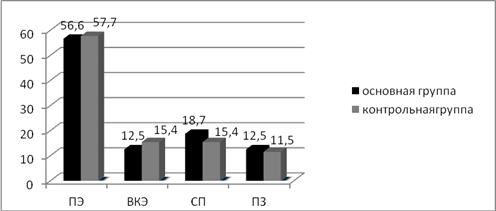
Рис. 2. Процентное соотношение эффективности консолидирующей терапии у больных в исследуемых группах
Оценивая токсичность и инфекционные осложнения проводимой терапии, мы получили следующие результаты: в контрольной группе, где применялась полихимиотерапия без использования полиоксидония из 216 курсов, анемией III степени осложнились 15 курсов (6,9%), IV степени – 4 (1,8%). Лейкопения III степени зарегистрирована после 27 курсов (12,5%), IV степени – после 10 курсов (4,6%). С целью купирования лейкопении III и IV степени, а также для профилактики острых септических осложнений вводился КСФ (нейпоген, граноцит) после 26 курсов (12%) ПХТ. Развитие агранулоцитоза в сочетании с иммунодепрессией в 6 наблюдениях (2,8%) привело к развитию фебрильной нейтропении, для купирования которой пациенты получали КСФ, антибактериальную, антимикотическую и антипневмоцистную терапию. Осложнения бактериальной природы (поражение кожи, пневмонии, цистит) на фоне проведения ПХТ отмечены после 9 курсов (4,2%), грибковые поражения — после 4 курсов (1,8%) ПХТ. Осложнения вирусной природы были представлены острой респираторной вирусной инфекцией, что вызывало необходимость прерывания или откладывания начала курса аутогемохимиотерапии в 12,9% (28 курсов), а также простым герпесом после 10 курсов ПХТ (4,6%). С целью купирования анемии III и IV степени вводился эритропоэтин (рекармон, эпрекс) после 11 курсов (5,1%) системной полихимиотерапии (рис. 3, 4).
В основной группе, где применялась полихимиотерапия с иммунокоррекцией полиоксидонием, анемия III степени отмечалась на 2 курсах у 1 пациента с (1,8%), IV степени — на 2 курсах у 1 пациентки (1,8%), этим больным с целью купирования анемии вводился эритропоэтин (рекармон).
Лейкопенией III степени в основной группе осложнилось 10 курсов ПХТ (8,9%), лейкопения IV степени зарегистрирована после 2 курсов ПХТ (1,8%). При всех курсах, осложнившихся лейкопенией IV степени, и при 6 курсах, осложнившихся лейкопенией III степени (14,3%), вводились КСФ (нейпоген, граноцит, грасальва). Фебрильная нейтропения отмечалась у 1 пациентки после 2 курсов (1,8%) ПХТ с применением иммунокоррекции полиоксидонием. Осложнения бактериальной природы (поражение кожи, пневмонии, цистит) на фоне проведения ПХТ с иммунокоррекцией отмечены после 2 курсов (1,8%), грибковых поражений не было зарегистрировано ни на одном курсе ПХТ с иммунокоррекцией. Явления стоматита различной степени тяжести зарегистрированы после 4 курсов (3,6%). Острая респираторная вирусная инфекция наблюдалась на 11 курсах ПХТ с иммунокоррекцией (9,8%), герпетическая инфекция отмечалась после 3 курсов (2,7%) (рис. 3, 4).
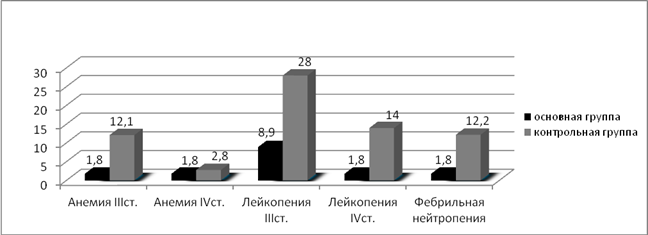
Рис. 3. Процентное соотношение эффективности индукционной терапии у больных в исследуемых группах
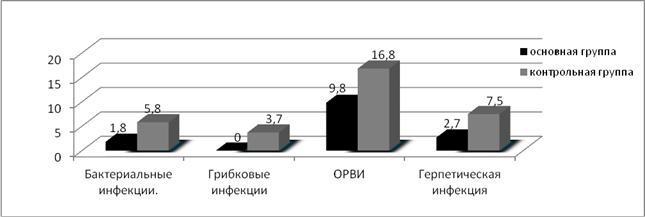
Рис. 4. Процентное соотношение инфекционных осложнений на фоне курсов ПХТ в исследуемых группах
При изучении иммунного статуса у пациентов до лечения отмечалось достоверное снижение по сравнению со здоровыми детьми относительных показателей иммунограммы CD20-лимфоцитов на 15%, CD4 – на 25,7% и CD25 – на 40%. Из абсолютных значений иммунограммы достоверно также снижались показатели CD20 – на 16,7%, CD4 – на 30,9% и CD25 – на 42,9%. По остальным абсолютным показателям достоверных отличий не выявлено.
Нами проведена оценка иммунного статуса больных после проведенной химиотерапии на 10–14-й день от начала курса, т.е. в момент развития максимальной миелосупрессии. В контрольной группе, где больные проходили системную полихимиотерапию, отмечено снижение процентного содержания Т-клеток – достоверно снижаются уровни CD2+, CD4+, CD25+ лимфоцитов, а также СD20+лимфоцитов. В отношении других количественных показателей иммунограммы достоверных изменений не выявлено. При изучении абсолютных значений выявлено достоверное снижение уровня всех иммунокомпетентных клеток по сравнению с исходным уровнем, что обусловлено развитием миелосупрессии после курса системной полихимиотерапии.
В основной группе, где больные проходили полихимиотерапию с полиоксидонием, также отмечено угнетение иммунного статуса как по Т-клеточному звену, так и по В-клеточному звену. Однако по сравнению с контрольной группой отмечаются достоверные положительные различия по CD2 на 12%, CD20 на 12,8%, CD4 на 25,4%. При изучении абсолютных значений количества иммунокомпетентных клеток в основной группе выявлено достоверное улучшение показателей CD2 на 13%, CD4 на 17,2% по сравнению с контрольной группой, что обусловлено менее выраженной миелосупрессией в основной группе. Иммунорегуляторный индекс в основной группе после каждого курса полихимиотерапии с полиоксидонием был выше, чем в контрольной группе (1,17 против 0,85 соответственно) (р<0,05).
С целью оценки влияния полиоксидония на фагоцитарное звено иммунитета исследовали индекс стимуляции нейтрофилов в НСТ-тесте. Оказалось, что индекс стимуляции нейтрофилов у больных, получавших полиоксидоний на фоне полихимиотерапии, достоверно выше, чем у больных на фоне системной полихимиотерапии (1,3 против 0,89 соответственно) (р<0,05).
Выводы:
1. Достоверных отличий в непосредственных результатах лечения между ПХТ и ПХТ с использованием полиоксидония не выявлено.
2. Применение полиоксидония при полихимиотерапии способствует снижению частоты инфекционных осложнений бактериальной природы – 1,8 % и вирусной природы – 12,5% по сравнению с системной полихимиотерапией (6,5% и 24,3% соответственно) (р<0,05).
3. Применение полиокидония на фоне полихимиотерапии позволяет снизить тяжесть иммуносупрессии и достигнуть достоверного улучшения иммунологических показателей, характеризующих Т-клеточное звено и фагоцитарное звено (индекс стимуляции нейтрофилов) (р<0,05).
4. Применение полиоксидония при проведении полихимиотерапии сопровождается достоверным снижением частоты лейкопении III и IV степени тяжести (8,9% и 1,8% соответственно) по сравнению с обычной полихимиотерапией (28% и 14% соответственно) (р<0,05).
Рецензенты:
Николаева Н.В., д.м.н., ассистент кафедры онкологии Ростовского государственного медицинского университета, г. Ростов-на-Дону;
Каймакчи О.Ю., д.м.н., ассистент кафедры онкологии Ростовского государственного медицинского университета, г. Ростов-на-Дону.



