Реология – это раздел физической механики, посвященный изучению процесса течения. В настоящее время она включает в себя практически все аспекты процесса деформирования материалов под влиянием приложенных внешних напряжений. По существу, реология изучает особенности восприимчивости материалов (в том числе полимерных), находящихся в различных агрегатных состояниях, к приложению внешнего поля сил [1].
Вязкость растворов, содержащих макромолекулы, обычно выше вязкости растворов низкомолекулярных соединений и коллоидных растворов тех же концентраций [2]. Только очень разбавленные растворы высокомолекулярных соединений можно считать подчиняющимися законам Ньютона и Пуазейля. Долгое время высокую вязкость растворов высокомолекулярных соединений объясняли большой сольватацией макромолекул. Однако впоследствии, в связи с обнаружением сравнительно незначительной сольватации макромолекул, пришли к убеждению, что отклонения вязкости растворов высокомолекулярных соединений от законов, которым подчиняются растворы низкомолекулярных веществ, следует объяснить особенностями гидродинамики систем, содержащих вытянутые и гибкие макромолекулы, и наличием в них ассоциатов и легко разрушаемых структур [3].
На форму макромолекулы в растворе существенным образом влияет природа растворителя. В одном растворителе молекулы полимеров могут быть более вытянуты, в другом – более свернуты в клубок. Как правило, чем лучше полимер растворяется в данной жидкости, чем более он сольватирован, тем меньше участки молекулярной цепи взаимодействуют друг с другом, тем более вытянуты макромолекулы и тем выше вязкость раствора. В плохом растворителе макромолекулы мало сольватированы и поэтому образуют более компактные клубки. Таким образом, для одного и того же полимера, растворенного в различных растворителях, будет меняться гидродинамическое сопротивление макромолекул потоку жидкости, а следовательно, и характеристическая вязкость.
Помимо зависимости коэффициента вязкости от градиента скорости для растворов средней концентрации наблюдаются и другие аномалии, например, увеличение вязкости при стоянии раствора, уменьшение вязкости после нагревания и последующего охлаждения раствора, после перемешивания и т.д. Все эти аномалии являются следствием неравновесности раствора, с которым имеет дело экспериментатор, и происходят из-за склонности системы к структурированию [4].
Весьма характерно изменение вязкости растворов полимеров с увеличением их концентрации. В отличие от растворов низкомолекулярных соединений, для которых характерно линейное возрастание вязкости от концентрации, для растворов полимеров с повышением концентрации вязкость этого раствора возрастает очень резко по кривой, обращенной выпуклостью к оси концентрации. Одной из причин резкого увеличения вязкости с повышением концентрации является образование в системе структур.
На вязкость, так же как и на осмотическое давление достаточно концентрированных растворов высокомолекулярных веществ, может влиять способ приготовления раствора. И здесь такое влияние объясняется медленным установлением равновесия в системе.
Гелеобразование. Растворы высокомолекулярных веществ в известных условиях теряют свою текучесть, т.е. переходят в гели. Гелеобразование может происходить спонтанно (самопроизвольно), в результате изменения температуры, при концентрировании раствора или при добавлении к нему не слишком больших количеств электролита. Как правило, под действием этих факторов структурная вязкость системы возрастает, что приводит к превращению жидкости в гель – систему, проявляющую ряд свойств твердого тела [5].
Причина гелеобразования состоит в возникновении связей между молекулами высокомолекулярного вещества, которые в растворе представляли собою кинетические отдельности. Между молекулами полимера в растворе могут образовываться кратковременные связи, приводящие к возникновению ассоциатов. Однако если средний период существования связей между макромолекулами станет очень большим (практически бесконечным), то ассоциаты не будут распадаться и возникшие образования проявят в некоторой степени свойства твердой фазы. Постоянные связи между молекулами в растворах высокомолекулярных веществ могут образовываться в результате взаимодействия полярных групп макромолекул или ионизированных ионогенных групп, несущих электрический заряд различного знака, и, наконец, между макромолекулами могут возникать химические связи. Таким образом, гелеобразование есть не что иное, как процесс появления и постепенного упрочнения в гелеобразующей системе пространственной сетки.
Повышение температуры, если только при этом в системе не происходит необратимых химических изменений, обычно препятствует гелеобразованию из-за возрастания интенсивности микроброуновского движения сегментов и уменьшения вследствие этого числа и длительности существования связей, возникающих между макромолекулами. Наоборот, понижение температуры, как правило, способствует гелеобразованию, так как при этом спектр контактов между макромолекулами расширяется и сдвигается в сторону большей прочности. Следует заметить, что переход раствора в гель, равно как и геля в раствор, с изменением температуры совершается непрерывно, т.е. в этом случае не существует температур, подобных температурам кристаллизации или плавления.
Чем выше концентрация, тем выше температура, при которой растворы высокомолекулярных веществ переходят в гели.
На способность к гелеобразованию водных растворов амфотерных высокомолекулярных электролитов весьма сильно влияет рН раствора. Гелеобразование лучше всего идет при значении рН, отвечающем изоэлектрической точке, так как при этом по всей длине молекулярной цепи расположено одинаковое число противоположно заряженных ионизированных групп, что способствует установлению связи между отдельными макромолекулами. С изменением рН (в обе стороны от изоэлектрической точки) макромолекулы приобретают одноименный заряд, что препятствует образованию между ними связи. При добавлении больших количеств кислоты или щелочи степень ионизации ионогенных групп уменьшается, и тенденция к гелеобразованию снова увеличивается.
Также на способность к гелеобразованию влияет наличие низкомолекулярных нейтральных электролитов
Большинство гелей, встречающихся в растительном и животном мире, обладают анизотропией, обусловленной условиями образования этих гелей. Причиной анизотропии искусственно полученных гелей обычно является неравномерная деформация их при образовании или неравномерная усадка при высушивании. Примером может служить гель, полученный высушиванием раствора желатина на стеклянной пластинке. Очевидно, усадка в таких условиях может происходить только по толщине пленки геля, в результате чего макромолекулы желатина будут ориентированы преимущественно параллельно плоскости пластинки.
Основанием для проведения научно-исследовательских, технологических работ является Договор № 1 от 01.01.2013 на выполнение научно-исследовательских, опытно-технологических работ с Дополнением № 1 от 13.02.2013 в рамках Комплексного проекта «Разработка технологии и организация высокотехнологичного промышленного производства фармацевтического желатина для капсул и его аналогов» по постановлению Правительства РФ № 218, 3 очередь.
Объекты и методы исследований
Для проведения технологических операций по получению твердых капсул фармакологического назначения, как правило, готовят водный раствор из отобранных компонентов. Чтобы получить капсулы со стенками равномерной толщины, необходимо приготовить раствор с определенной (заданной) вязкостью. Вязкость растворов в общем случае зависит от многих условий, таких как состав раствора, концентрации компонентов, температура раствора, рН среды, наличие электролитов в растворе, а также от условий приготовления. Для того чтобы составить рецепт приготовления раствора с оптимальными характеристиками, необходимо изучить реологические свойства водных растворов индивидуальных компонентов.
Для анализа реологических свойств растворы образцов растительных аналогов фармацевтического желатина разной концентрации (0,5, 1, 1,5%) готовили в деионизованной воде. Растворы оставляли на ночь при 4 °С. На следующий день образцы перемешивали при комнатной температуре до полного растворения пектина.
Затем от растворов отбирали пробы по 20 мл, которые нагревали до 100 °С и перемешивали в течение 5 мин. Затем охлаждали до 25 °С.
Для измерения зависимости от рН растительные аналоги растворяли в универсальной буферной смеси (0,04 М уксусной кислоты, 0,04 М фосфорной кислоты, 0,04 М борной кислоты) с соответствующими значениями рН (2-6, с шагом 1). Растворы пектинов для всех значений рН готовили с концентрацией 1,5%. Растворы оставляли на ночь при 4 °С. На следующий день образцы перемешивали при комнатной температуре до полного растворения пектина. При необходимости доводили рН до нужного значения NaOH или HCl.
Затем от растворов отбирали пробы по 20 мл, которые нагревали до 100 °С и перемешивали в течение 5 мин. Затем охлаждали до 25 °С.
В рамках данного исследования вязкость измеряли на вискозиметре ротационного типа Brookfield LVDV-II+Pro (шпиндели 00, 18, 34), в основе работы которого лежит метод коаксиальных цилиндров (метод Куэтта). Все измерения проводили в термостатируемых стаканах, прилагающихся к вискозиметру. Для термостатирования использовали криотермостат LOIP FT-211-25 (Россия). Объем образцов составлял 10 мл. Градиент скорости сдвига в ходе измерения динамической вязкости определяли исходя из геометрии шпинделя и стакана, в котором проводили измерения.
Результаты и обсуждение
Результаты измерений представлены на рис. 1.
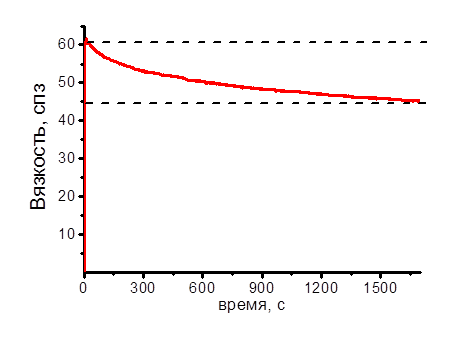
Рис. 1. Зависимость измеряемой вязкости 5%-ного водного раствора растительного аналога фармацевтического желатина от времени. Измерения проводили при 25 °С, градиент скорости сдвига составил 12,2 с-1. Пунктирными линиями обозначены диапазоны изменения вязкости
Из рисунка 1 видно, что измеряемое значение вязкости снижается с 60 спз в начале измерения до 45 спз в конце измерения (измерение проводили около 30 мин). Это свидетельствует о структурных перестройках в данном растворе растительного аналога, характерные времена которых составляют десятки минут. Вероятно, происходит постепенное снижение числа межмолекулярных контактов, обусловленное ориентацией молекул по направлению течения жидкости в ходе измерения (т.е. по окружностям).
Из представленных результатов следует, что наблюдаемое значение вязкости для водных растворов полисахаридов, при прочих равных условиях, может зависеть от процедуры измерения. Это означает, что параметры технологических процессов, используемых при производстве капсул фармакологического назначения, также могут влиять на проявляемые смесями реологические свойства. Так, при включении в состав смесей значительного количества крахмалов необходимо будет особое внимание уделить подбору времен проведения основных технологических операций.
Выводы
По результатам анализа реологических свойств водных растворов растительных аналогов фармацевтического желатина для получения капсул медицинского назначения можно сделать следующие выводы.
Водные растворы растительных аналогов ведут себя аналогично растворам низкомолекулярных соединений. Вязкость варьирует в диапазоне 10–100 спз (для 1,0-1,5%-ных водных растворов). Нагревание до 100 °С при рН 6 приводит к необратимому разрушению молекул растительных аналогов фармацевтического желатина.
По своим реологическим характеристикам, определяемым при 50-70 °С, водные растворы растительных аналогов фармацевтического желатина способны образовывать гель при комнатной температуре в достаточно низких концентрациях (начиная с 0,5%) и могут быть рекомендованы к добавлению в технологическую смесь для получения капсул медицинского назначения в качестве гелеобразующих агентов.
Рецензенты:
Яковченко М.А., д.х.н., профессор, ФГБОУ ВПО «Кемеровский государственный сельско-хозяйственный институт», г. Кемерово;
Пинчук Л.Г., д.х.н., профессор, ФГБОУ ВПО «Кемеровский государственный сельско-хозяйственный институт», г. Кемерово.



