Болезни костно-мышечной системы и соединительной ткани представляют важную медико-социальную проблему в связи с широкой распространенностью среди лиц трудоспособного возраста, занимая одно из ведущих мест в структуре общей и первичной заболеваемости населения Российской Федерации и других стран мира [10].
Одним из наиболее часто встречающихся в общетерапевтической и ревматологической практике вариантов наследственных нарушений соединительной ткани является синдром гипермобильности суставов (СГМС). По данным различных авторов, генерализованная суставная гипермобильность и СГМС отмечаются в популяции у 6–31,6% с вариабельностью в зависимости от возрастных, гендерных и этнических факторов [1, 5, 7].
Сочетание СГМС с костно-мышечными синдромами обусловлено облигатным вовлечением костной ткани в процесс дисплазии с разнообразием и полиморфизмом клинических проявлений. Более того, идентифицированные локомоторные симптомы относятся к согласованным критериям диагностики СГМС [5, 9].
При изучении костно-метаболических характеристик нарушения структуры и функции соединительной ткани у пациентов с СГМС особое значение приобретает интегральная оценка системных гормональных влияний, обеспечивающих регуляцию процессов костного и хрящевого ремоделирования.
Динамика противоположных, но взаимосвязанных и взаимообусловленных процессов костной резорбции и формирования, протекающих на протяжении всей жизни человека, составляет сущность цикла костного ремоделирования. Последовательно сменяющие друг друга фазы резорбции, реверсии и формирования кости генетически детерминированы и находятся под сложным многоуровневым нейрогуморальным контролем. На клеточные системы кости оказывают влияние гормоны, локальные тканевые факторы, сигналы межклеточных взаимодействий, центральные нейрогенные импульсы, обеспечивая постоянную репарацию и адаптацию костной ткани и ее собственную гормонально-метаболическую активность. Нарушение костного обмена и разобщение процессов ремоделирования способны вызвать остеопению и остеопороз [8].
Системные гормональные воздействия направлены в первую очередь на поддержание гомеостаза остеотропных минералов и их резервирование, что является важной функцией костной ткани. Удержание константы кальция в системной циркуляции, сопряженность его метаболизма в костной ткани, а также баланс внутри- и внеклеточных форм элемента регулируются системой «паратгормон (ПТГ) – кальцитонин – активная форма витамина D (кальцитриол)». При этом биологические эффекты ПТГ направлены на повышение уровня кальциемии за счет стимуляции почечной реабсорбции с одновременным снижением экскреции кальция с мочой. Синергизм ПТГ и кальцитриола по отношению к кальциемии реализуется через стимуляцию последним кишечной абсорбции кальция. Кроме того, кальцитриол стимулирует всасывание фосфора в тонком кишечнике и его канальцевую реабсорбцию в нефронах, тогда как ПТГ оказывает выраженный фосфатурический эффект. Фосфор стимулирует функциональную активность остеобластов, образующих белковые компоненты матрикса костной ткани; без него невозможна минерализация скелета. Модуляция синтеза ключевых гормонов-регуляторов фосфорно-кальциевого обмена – ПТГ и кальцитриола — происходит реципрокно за счет транскрипции соответствующих генов [2].
На клеточные системы, обеспечивающие костное ремоделирование, помимо кальций-регулирующих, оказывают влияние и другие гормоны эндокринной системы. Гуморальный сигналинг процессов костно-хрящевого роста, репарации и минерализации реализуется через основные – гормон роста, половые и так называемые пермиссивные гормоны – тиреоидные, кортикостероиды, инсулин.
Целью нашего исследования явилась оценка состояния некоторых облигатных и пермиссивных системных гормональных регуляторов костно-хрящевого ремоделирования у пациентов с синдромом гипермобильности суставов.
Материал и методы
Показатели минерального обмена и уровни гормонов, оказывающих влияние на костное и хрящевое ремоделирование, изучены у 80 пациентов (34 мужчин и 46 женщин) с СГМС в возрасте от 18 до 30 лет (средний возраст 22,9±3,8 лет). Гипермобильный синдром диагностировали по шкале Р. Beighton согласно действующим критериям [5, 9]. В исследование не включались больные с классифицируемыми наследственными заболеваниями. Изучали уровни кальция и фосфора в сыворотке крови, показатели суточной экскреции кальция и фосфора с мочой. С помощью иммунохемилюминисцентного анализа определяли уровни паратиреоидного гормона (ПТГ), 25(ОН) витамина D (25(ОН)D3), соматотропного гормона (СТГ), гормонов, характеризующих функцию щитовидной железы: тиреотропного (ТТГ), свободной фракции тироксина (сТ4), трийодтиронина (Т3), а также антитела к тиреоидным антигенам (тиреопероксидазе) – АТ к ТПО.
В контрольную группу были включены 25 человек, сопоставимых по полу и возрасту (средний возраст 22,3±3,6 лет), без внешних признаков дисплазии соединительной ткани, в том числе гипермобильного синдрома.
Полученные результаты статистически обработаны. Количественные данные представлены в виде средней и стандартной ошибки средней (M±m). Достоверность межгрупповых различий устанавливали с помощью критерия Ньюмена—Кейлса. Достоверность различий качественных признаков оценивали с помощью критерия χ2. Достоверными считали различия при p≤0,05.
Результаты и обсуждение
Выраженность суставной гипермобильности по шкале Beighton в 43,8% случаев соответствовала 5 баллам, у 20% обследуемых данный показатель составил 3 балла, у 26,2% – 4 балла. Значительные степени гипермобильности – 7 и 9 баллов — выявлены соответственно у 2,5% и 7,5% пациентов.
Оценка функции системы основных кальцийрегулирующих гормонов установила в группе пациентов с СГМС достоверное снижение среднего уровня ПТГ, однако значений, выходящих за пределы референсных, в обеих группах обследованных не отмечено (рис. 1).
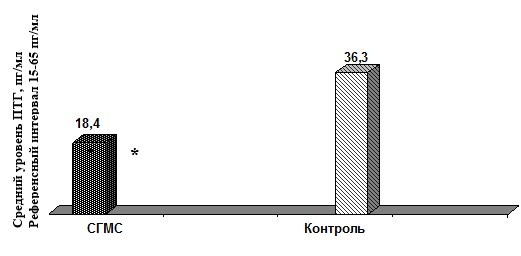
*р<0,05
Рис. 1. Сывороточный уровень ПТГ у пациентов с СГМС
Другой особенностью профиля регуляторов костного минерального обмена у пациентов с СГМС явилась достоверно высокая распространенность гиповитаминоза D – 22,2% против 4% в контрольной группе (р≤0,05). Следует отметить, что активные метаболиты витамина D (D-гормон) наряду с ПТГ осуществляют интегральную модулирующую роль в гомеостазе кальция и цикле костного ремоделирования.
Средние показатели сывороточного уровня 25(ОН)D3 у пациентов с СГМС при этом также были снижены (рис. 2).
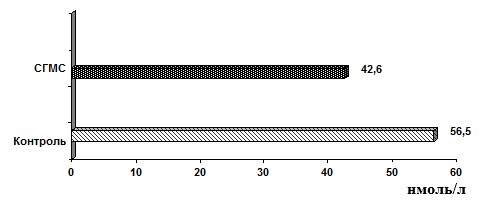
Рис. 2. Среднее содержание 25(ОН)D3 у пациентов с СГМС
При отсутствии статистически достоверных различий в сывороточных показателях 25(ОН)D3 у больных СГМС и в контрольной группе (р>0,05) в среднем результаты исследуемой группы соответствовали уровню «недостаточности» витамина D при референсном интервале 47,7–144,0 нмоль/л [2].
Выявленные в группе пациентов с СГМС особенности костного минерального обмена характеризовались незначительно сниженными или низконормальными показателями общего кальция крови на фоне сохраненного референсного значения фосфатемии. Гипокальциемия при этом отмечена у 23,8% обследуемых – достоверно (р<0,05) чаще, чем в контрольной группе. Суточная кальцийурия и фосфатурия соответствовали референсным показателям и результатам группы контроля (2,01±1,28 и 16,74±7,74 ммоль/л/сутки vs 2,07±0,84 и 13,42±5,93 соответственно), что позволило исключить из причин развития гипокальциемии у пациентов с СГМС повышение почечной экскреции электролитов. Таким образом, нарушение кальциевого гомеостаза связано преимущественно с недостаточной кишечной и почечной абсорбцией на фоне гиповитаминоза D и депривации ПТГ.
Недостаточное поступление кальция и длительно существующая некомпенсированная гипокальциемия могут приводить к снижению минеральной плотности костной ткани и ухудшению качества кости, являясь фактором риска остеопороза с высоким уровнем доказательности [4]. Дефицит витамина D также относится к доказанным модифицируемым факторам нарушения костной минеральной плотности и склонности к падениям, суммарно повышающим риск переломов [3].
Немаловажное патофизиологическое значение гиповитаминоза D для пациентов с СГМС также обусловлено плейотропными эффектами 25(ОН)D3 на хрящевую и мышечную ткани. Мышечная сила и уровень тонуса периартикулярных мышц играют большую роль в поддержании архитектоники, функциональной способности и стабильности сустава. Гипотонус окружающих сустав мышц наряду с чрезмерной растяжимостью связок, снижением проприоцептивного суставно-мышечного чувства и дефектным состоянием костно-хрящевых элементов у пациентов с СГМС обусловливают возникновение подвывихов и вывихов, приобретающих зачастую упорное и рецидивирующее течение. Витамин D является одним из важнейших регуляторов мышечной функции. Его влияние не ограничивается регуляцией метаболизма кальция – основного медиатора в мышечной ткани, обеспечивающего контроль акта сокращения и расслабления мышц. Помимо синхронизации транспорта кальция и фосфора, кальцитриол стимулирует дифференцировку миобластов, мышечных волокон. Стимуляция нейромышечной передачи обеспечивается через собственный рецептор VDR, другие рецепторы, а также внутриклеточный пул кальция. Рецепторы к D-гормону экспрессируются самими скелетными миоцитами. Снижение плотности этих рецепторов, их аффинности, снижение концентрации D-гормона в крови могут приводить к ослаблению мышечной силы и повышать склонность к падениям [3].
Еще одним фактором, определяющим значение оптимального содержания витамина D при СГМС, является участие в метаболизме хрящевой ткани [2]. Так, витамин D и ряд его промежуточных метаболитов стимулируют синтез протеогликана хондроцитами, снижают продукцию и активность металлопротеиназ, вызывающих деструкцию хряща. При недостаточности витамина D наблюдается снижение уровня всех метаболитов в сыворотке, особенно 25(ОН)D и 24,25(ОН)2D. Следует отметить, что именно 24,25(ОН)2D преимущественно влияет на метаболизм хрящевой ткани. Таким образом, дефицит витамина D сопровождается нарушением метаболизма суставного хряща, его ремоделированием и утолщением субхондральной костной ткани. Это снижает амортизационные способности суставных поверхностей и ускоряет дегенеративные изменения в хрящевых структурах, приводя к формированию осложнений СГМС.
Удержание сбалансированности процессов костного ремоделирования, как известно, не требует непосредственных гормональных воздействий и подчиняется напрямую тканевым пептидным медиаторам [8]. Однако кость как акцептор гормонов находится под влиянием целого ряда системных гуморальных факторов. При этом гормональная регуляция ремоделирующей единицы реализуется через изменение выживаемости и функциональной активности костных клеток и опосредование ответа костной ткани на физические нагрузки.
Облигатными гормонами, непосредственно участвующими в процессах роста и образования костной и хрящевой ткани, являются гормон роста и половые стероиды. Исследование содержания СТГ у пациентов с СГМС не продемонстрировало отклонений относительно референсного диапазона и по сравнению с контрольной группой.
Роль тиреоидных гормонов в регуляции ростовых процессов определяется как пермиссивная или разрешающая – ростовое действие СТГ осуществляется только при нормальном содержании тиреоидных гормонов. Присутствие их в физиологической концентрации необходимо также для экспрессии генетически запрограммированной способности тканей органов и систем к дифференцировке, росту и созреванию. Тиреоидные гормоны стимулируют рост клеток и тканей, обеспечивают нормальные процессы роста и созревание скелета. В супрафизиологических концентрациях тиреоидные гормоны разобщают процессы костного ремоделирования, усиливая костную резорбцию. Именно поэтому исследование тиреоидного статуса у больных с гипермобильным синдромом представляло особый интерес (рис. 3).
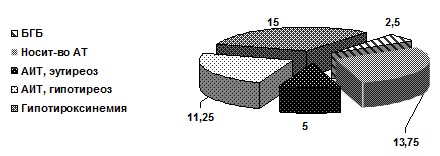
Рис. 3. Тиреоидные гормоны и маркеры иммунных тиреопатий у пациентов с СГМС (%)
С наибольшей частотой у пациентов с СГМС встречались изолированная гипотироксинемия, бессимптомное носительство антител к тиреоидной пероксидазе и гипотиреоз на фоне аутоиммунного тиреоидита (р>0,05).
Случаи изолированной гипотироксинемии в исследуемой группе, вероятно, могут быть расценены как сниженные адаптивно-приспособительные возможности у больных СГМС в условиях легкой йодной эндемии. Это указывает на необходимость применения более активных профилактических стратегий возмещения дефицита йода у молодых пациентов с СГМС.
Изолированное повышение титра антитиреоидных антител без нарушения функции железы и соответствующих ультразвуковых или гистологических феноменов, как известно, самостоятельного клинического значения не имеет и может определяться в 5–10% здоровой популяции, особенно среди женщин [6]. Вместе с тем носительство антител рассматривается как фактор риска аутоиммунных и деструктивных тиреопатий и развития стойкого гипотиреоза с целесообразностью динамического контроля функции щитовидной железы, особенно у женщин репродуктивного возраста.
Классическая развернутая клиническая картина тиреоидита Хашимото, включающая наличие манифестного или субклинического гипотиреоза у иммуннокомпетентных лиц, наблюдалась в 11,25% случаев СГМС (р>0,05). Учитывая молодой возраст обследуемых, во всех случаях, в том числе и при субклиническом гипотиреозе, пациентам назначена заместительная тиреоидная терапия препаратами Левотироксина.
У 4 (5%) больных СГМС наблюдалось сочетание повышенного титра АТ к ТПО и соответствующих ультразвуковых феноменов при сохраненном эутиреоидном статусе, что по существующим клиническим рекомендациям позволило установить диагноз аутоиммунного тиреоидита без нарушения функции щитовидной железы [6] с необходимостью последующего динамического контроля тиреоидной функции.
Всего же повышенный титр антитиреоидных антител установлен у 24 (30%) пациентов с СГМС, что, безусловно, превышает популяционные показатели (р≤0,05). Таким образом, лица с гипермобильным синдромом имеют повышенный риск развития аутоиммунных тиреопатий и могут рассматриваться в качестве целевой группы для скрининга нарушений функции щитовидной железы.
Болезнь Грейвса отмечена у 2 (2,5%) пациентов с СГМС: ее распространенность существенно не отличалась от общепопуляционной [6]. Это позволило исключить тиреотоксикоз из числа факторов, приводящих к нарушению метаболических процессов и костного ремоделирования при гипермобильном синдроме.
Установленные особенности в состоянии системных гормональных регуляторов костного метаболизма способствуют пониманию механизмов развития остеопенического синдрома у пациентов с СГМС, расширяя представления о нарушениях костно-хрящевого ремоделирования при гипермобильном синдроме. Для своевременного выявления недостаточности витамина D с адекватным его восполнением и коррекции дефицита кальция необходимо включение показателей костного метаболизма в алгоритм обследования пациентов с СГМС. Также в группе больных с гипермобильным синдромом представляется целесообразным проведение тиреоидного скрининга.
Рецензенты:
Ягода А.В., д.м.н., профессор, заслуженный деятель науки РФ, заведующий кафедрой госпитальной терапии Ставропольского государственного медицинского университета, г. Ставрополь;
Чагай Н.Б., д.м.н., профессор кафедры эндокринологии, детской эндокринологии и диабетологии Ставропольского государственного медицинского университета, г. Ставрополь.



