Одним из важнейших факторов риска для для биологического разнообразия Каспийского бассейна является загрязнение акватории моря различными токсикантами, особенно тяжелыми металлами и пестицидами. Основными источниками загрязнения поверхностных вод является сток с территорий промышленных площадок, населённых пунктов, животноводческих ферм, других объектов сельскохозяйственного производства, а также водный транспорт. На летний период 2014 года в морской воде прибрежного Каспия содержание кадмия составило 0,25 мг/л, свинца – 1,14 мг/л, марганца – 5,01 мг/л.
Совместное действие данных ксенобиотиков негативно влияет на морфологические, физиологические, генетические и биохимические показатели рыб, сокращая их численность и воспроизводство. Химические соединения особенно губительны для гидробионтов на ранних стадиях их развития [1].
Интегральным показателем состояния организма рыб в условиях действия токсических веществ является количественные и качественные изменения состава крови [1].
В этой связи целью нашей работы явилось сравнительное изучение комбинированного влияния ионов Сd2+, Pb2+, Mn2+ и пестицида актара на качественные показатели мембран эритроцитов периферической крови сеголеток карпа. Из поставленной цели вытекает задача определения особенностей кислотной устойчивости эритроцитов периферической крови сеголеток карпа при воздействии смеси ионов тяжелых металлов (Сd2+, Pb2+, Mn2+) и пестицида актара.
Материалы и методы. Объектом исследования явились сеголетки карпа (5–6 мес, массой 100–150 г) обоего пола (CyprinuscarpioL.), отловленные из прудов Широкольского рыбокомбината в осеннее время (ноябрь 2014 года) перед их переброской в зимовальные пруды.
Карповые были перевезены в специальных, мешочках с кислородом из с. Юрковка Тарумовского района Республики Дагестан в Махачкалу на биологический факультет Дагестанского государственного университета.
Опыты проводили в аквариумах объемом 250 л. В каждом аквариуме содержались по 15–20 рыб и создавались условия постоянного температурного и газового режима. Постоянную аэрацию аквариумов создавали с помощью специальных аэраторов. В течение одного месяца рыбы проходили адаптацию в условиях аквариума, при которых часть рыб погибала. В эксперименте использовались выжившие рыбы.
Нами испытано совместное влияние Pb2+ (1 мг/дм3), Cd2+(0,05 мг/дм3) и Mn2+(0,1 мг/дм3)(ПДК для рыбохозяйственных водоемов 0,1мг/дм3, 0,005 мг/дм3, 0,01 мг/дм3 соответственно) [3], а также пестицида актара (0,3 мг/дм3)(ПДК для рыбохозяйственных водоемов 0,01мг/дм3).
Контрольную группу рыб содержали в воде без добавления токсикантов. На 5-й и 15-й дни эксперимента проводили определение кислотной резистентности мембран эритроцитов.
Кровь брали прокалыванием из хвостовой вены.
Определение кислотной резистентности эритроцитов проводили методом кислотных эритрограмм, предложенным И.А. Терсковым и И.И. Гительзон [9].
Результаты и их обсуждение. Результаты показали различия кислотных ритрограмм контрольных и подопытных рыб.
Как видно из представленных данных (таблица; рис.1,2), для эритрограммы контрольных рыб характерна одна вершина с максимумом на 1,0 мин. В этой точке гемолизирует 30,7 % эритроцитов. Продолжительность гемолиза составляет 6,0 мин. Размах основания пика – 2,5 мин. Доля эритроцитов с минимальной стойкостью (в интервале 1–2 мин) составляет 83,5 %, в меньшем количестве представлены эритроциты со средней стойкостью (в интервале 2,5–4,5 мин) – 12,9 % и практически отсутствуют высокостойкие эритроциты (в интервале от 5,0 до 6 мин).
Пребывание рыб в среде со смесью ионов трех металлов в течение 5 суток привело к сдвигу эритрограммы влево к 0,5 мин и повышению доли эритроцитов, подвергшихся гемолизу на пике эритрограммы, до 76,1 %. Продолжительность кислотного гемолиза сокращена до 3,5 мин. В этот период отмечается значительное преобладание низкостойких (93,4 %) эритроцитов. Доля среднестойких эритроцитов снижается до 5,1 % эритроцитов. Высокостойких эритроцитов на 5-й день эксперимента не обнаружено (рис. 1).
Кислотная эритрограмма сеголеток карпа, подвергшихся воздействию ионов тяжелых металлов в течение 15 суток, характеризуется почти полным разрушением эритроцитов (95,1 %) на 0,5 минуте, значительным сокращением времени гемолиза (1 мин) и полным преобладанием низкостойких эритроцитов (100,0 %). Средне- и высокостойких эритроцитов на 15- день воздействия смеси тяжелых металлов не обнаружено (рис. 1).
Сходные, но с менее выраженной патологией, изменения кислотной устойчивости эритроцитов к действию гемолитика, были получены в нашей лаборатории при изучении раздельного влияния ионов Pb2+, Cd2+ и Mn2+[3].
Показатели кислотной резистентности эритроцитов крови сеголеток карпа при действии смеси тяжелых металлов и пестицида (M±m, n = 20)
|
Время (мин) |
Контроль |
Опыт |
|||
|
Тяжелые металлы (Pb2+, Cd2+, Mn2+) |
Пестицид Актара |
||||
|
5 сутки |
15 сутки |
5 сутки |
15 сутки |
||
|
0,5 |
0,2±0,04 |
76,1±3,4 |
95,1±4,1 |
0 |
0 |
|
1 |
30,7±1,1 |
11,0±2,1 |
5,2±0,8 |
5,9±0,6 |
10,4±1,1 |
|
1,5 |
28,1±1,3 |
4,1±1,1 |
0 |
11,8±0,9 |
13,2±1,3 |
|
2 |
24,2±0,9 |
2,3±0,7 |
0 |
53,8±4,1 |
3,3±0,7 |
|
2,5 |
9,7±0,7 |
4,3±0,8 |
0 |
12,8±1,5 |
61,5±4,3 |
|
3 |
1,9±0,02 |
0,6±0,04 |
0 |
5,9±0,9 |
10,1±1,2 |
|
3,5 |
0,4±0,01 |
0,2±0,09 |
|
3,6±0,09 |
0 |
|
4 |
0,2±0,03 |
0 |
|
0 |
|
|
4,5 |
0,7±0,01 |
0 |
|
|
|
|
5 |
0,5±0,02 |
0 |
|
|
|
|
5,5 |
0,3±0,04 |
|
|
|
|
|
6 |
0,2±0,01 |
|
|
|
|
Следует отметить, что в условиях раздельного хронического действия ионов тяжелых металлов продолжительность жизни рыб была намного больше (40 суток и более) по сравнению с комплексным их действием (15 суток).
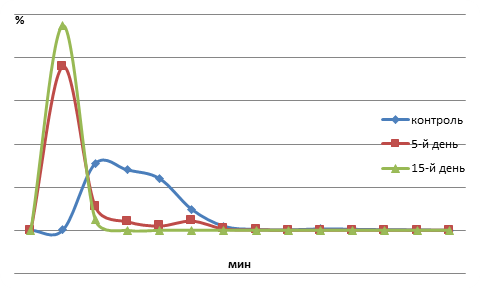
Рис. 1. Динамика резистентности эритроцитов крови сеголеток карпа при комплексном влиянии ионов тяжелых металлов (Сd2+, Pb2+, Mn2+)
При раздельном воздействии ионов Pb2+, Mn2+ и Cd2+ в течение 30 суток пик эритрограмм приходится к 0,5, 1,0 и 1,5 мин соответственно. Доля эритроцитов, подвергшихся гемолизу на пиках эритрограмм, значительно (~в 3 раза) выше контроля при длительном действии ионов Pb2+ и Mn2+ и почти соответствует контролю (36,0 %) при воздействии ионов Cd2+. Значительно сокращено время гемолиза: при содержании рыб в среде с Pb2+ и Mn2+ оно составляет 2,5 мин; при воздействии Cd2+ - 4,5 мин [3].
Характер воздействия пестицида актара на кислотную устойчивость эритроцитов рыб имеет свои отличительные особенности. Это выражается в сдвиге эритрограммы вправо, что свидетельствует о притоке в кровяное русло молодых эритроцитов. Однако значительный процент гемолизированных эритроцитов на пике эритрограммы позволяет утверждать об их быстром разрушении.
Как видно из рисунка 2, на 5-й день воздействия актары пик эритрограммы приходится на 2 мин. В этой точке гемолизу подвергается около 53,8 % эритроцитов. Гемолиз завершается на 3,5 мин. Доля низко-, средне- и высокостойких эритроцитов составляет соответственно 84,3; 9,5 и 0 %.
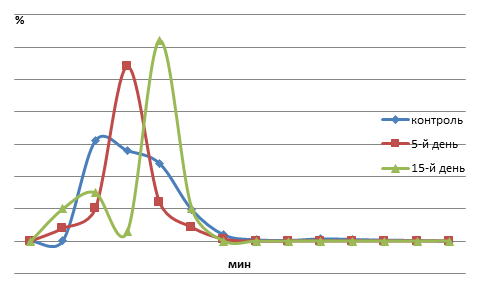
Рис. 2. Динамика резистентности эритроцитов крови сеголеток карпа при воздействии пестицида актара
На 15-й день воздействия пестицида актара продолжительность эритрограммы составляет 3 мин, пик эритрограммы наступает на 2,5 мин гемолиза. К этому времени гемолизу подвергалось 61,5 % эритроцитов. Эритрограмма также одновершинна. Размах пика составляет 3,0 мин. При этом отмечаются незначительные изменения в соотношениях числа эритроцитов с различной устойчивостью по сравнению с контролем.
Обсуждение результатов. Результаты проведенных исследований показали, что изучаемые токсиканты оказывали существенное влияние на функциональное состояние мембран эритроцитов сеголеток карпа. Анализ кислотных эритрограмм позволил определить характер их влияния на распределение эритроцитов по степени их устойчивости, а также на начало, интенсивность и завершение процесса их разрушения под действием повреждающего агента.
Полученные результаты свидетельствуют о значительных качественных изменениях состава эритроцитарной популяции сеголеток карпа, подвергшихся хроническому воздействию солей тяжелых металлов и пестицида актара.
Преобладание эритроцитов с низкой кислотной резистентностью указывает на значительное cокращение продолжительности их функционирования, которое может быть связано с деструктивными процессами, развивающимися в эритроцитарных мембранах в условиях хронической интоксикации организма смесью ионов свинца, кадмия и марганца, а также пестицида актара.
При обсуждении возможных механизмов влияния веществ необходимо учитывать ряд моментов. Известно, что любые ксенобиотики способны влиять на клеточный метаболизм, стимулируя или угнетая течение биологических процессов. Согласно имеющимся сведениям, костно-мозговая ткань характеризуется лабильностью и способностью изменять свою активность при различного рода воздействиях [7]. В этой связи отмеченное в работе ослабление исходной сопротивляемости эритроцитов при действии смеси тяжелых металлов может быть обусловлено влиянием данных токсикантов на кроветворные органы и вследствие этого – негативного воздействия на эритропоэз и выходом в периферическое русло клеток с измененными свойствами. В то же время пестицид актара в первую очередь действует на уровне циркулирующих клеток крови, снижая их устойчивость. В условиях непосредственного контакта в периферическом русле химические вещества могут оказывать различное влияние на биохимические системы, ответственные за сохранение целостности мембран эритроцитов, при этом усиливая или ослабляя их генетически детерминированную резистентность [5].
Можно считать, что независимо от химической природы токсиканта первым звеном его воздействия является повреждение структуры мембран [5]. Многие агенты воздействуют на белки мембран, способствуя их окислению и модификации. Например, свинец и ртуть и их соединения вызывают повреждение мембраны за счет блокады сульфгидрильных групп белковых молекул, входящих в состав биомембран. Подавляющее большинство гемолитических агентов вызывает повреждение мембраны, нарушая расположение молекул липидов в ней. Активные формы кислорода (O2-, H2O2, органические перекиси) взаимодействуют с липидами мембран, вызывая структурные нарушения и изменения проницаемости.
Оценивая степень клеточной резистентности, необходимо учитывать, что клетки, являясь конечным пунктом сложных адаптационных реакций, не только отражают общий уровень сопротивляемости организма, но и обеспечивают его.
Установленные в работе факты и ранее полученные данные свидетельствуют о способности тяжелых металлов и пестицидов разрушать целостность мембраны эритроцитов, что можно рассматривать в качестве модели быстрого старения эритроцитов и организма в целом. Старение красных клеток крови является патологическим процессом, который можно объяснить угнетением эритропоэза и нарушением стабильности и проницаемости эритроцитарных мембран, что в свою очередь может быть связано с активацией перекисного окисления липидов и снижением активности антиоксидантных ферментов [4].
Проведенные исследования показали, что изучение кинетики кислотного гемолиза при интоксикации солями тяжелых металлов и пестицида актара позволяет одновременно оценивать нарушения структуры эритроцитарных мембран и интенсивность работы кроветворных органов.
Рецензенты:
Эмирбеков Э.З., д.б.н., профессор кафедры общей биологии ЮФУ (филиал г. Махачкалы), г. Махачкала;
Абдусамадов А.С., д.б.н., директор Дагестанского филиала ФГУП «КаспНИРХ», г. Махачкала.



