Болезни пародонта в настоящее время представляют собой одну из наиболее важных и сложных проблем в стоматологии [10]. Особенно это актуально у лиц пожилого возраста в периоды адаптации к съемным зубным протезам. Далеко не всегда лекарственные средства, используемые в медицинской практике для сокращения сроков адаптации, приводят к положительному результату у пожилых пациентов [3, 10]. В связи с этим перспективным и актуальным на сегодняшний день направлением является поиск новых высокоэффективных препаратов, применяемых на различных этапах лечения широкого круга заболеваний [2, 3, 4, 5].
Одним из таких представителей можно считать препарат Тизоль® — аквакомплекс глицеросольвата титана. Тизоль® предохраняет ткани от высыхания и отека, усиливает их оксигенацию, не растекается, поскольку не является жидкостью [6]. В комплексе с Тизолем® с целью усиления фармакотерапевтического эффекта предлагается использовать бишофит, который в свою очередь также используется в современной стоматологии, оказывая противовоспалительное, антибактериальное, иммуностимулирующее действие. Бишофит регулирует проницаемость клеточной мембраны, нервно-мышечную возбудимость, а также улучшает периферическую микроциркуляцию.
Современные требования к лекарственным препаратам регламентируют качество продукции с учетом всех достижений регуляторной практики. В нашей стране разработка и производство такой продукции нормативно закреплены в Приказе № 916 от 14 июня 2013 г. «Правила организации производства и контроля качества лекарственных средств». Однако улучшению понимания качества продукта и процесса его производства способствует руководство ICHQ8 «Фармацевтическая разработка» (ICHQ8 PharmaceuticalDevelopment), которое разработано в рамках Международной конференции по гармонизации требований к регистрации лекарственных средств для человека (ICH – International Conference Harmonization). В нашей стране такого рода руководства носят пока рекомендательный характер. Руководство ICHQ8 предназначается для того, чтобы предоставить экспертам и инспекторам полное понимание продукта и производственного процесса. Оно позволяет регулятору использовать более гибкий подход, основанный на научном понимании «пространства проектных параметров», и определить, какие элементы процесса производства должны контролироваться и каким образом. Информация, полученная на этапе фармацевтической разработки (ICHQ8), может быть основой для последовательной оценки рисков качества конечной продукции.
Управление рисками по качеству может использоваться на различных этапах разработки продукта и процесса его производства, а также при внедрении в производство.
Целью исследования является разработка технологии стоматологического геля с учетом требований, изложенных в ICHQ8 «Фармацевтической разработка» и ICHQ9 «Управление рисками для качества».
Материалы и методы
В основу нашего дизайна исследования положены исследования по разработке технологии лекарственной формы, анализ воздействия критических точек производства и оценка их влияния на итоговое качество стоматологического геля с учетом требований GMP.
Результаты исследования и их обсуждения
В современных системах менеджмента риска такой процесс объясняется сочетанием вероятности возникновения опасности и серьезности наступивших последствий. Определение опасности дает возможность выявить потенциальный источник вреда в технологическом процессе. Возникновение рисков возможно на всех этапах жизненного цикла продукции – от поставки сырья, во время производства и контроля до процедуры распространения.
Одним из важных критериев документального подтверждения качества служит критическая контрольная точка (ККТ) – точка, где необходимо провести контроль для предупреждения или ликвидации опасности или уменьшить ее до допустимого уровня. В свете этого важным критерием является присутствие стандартных операционных процедур (СОП) и условий на фармацевтическом производстве, которые необходимы, чтобы обеспечить стабильное и качественное производство продукта.
Наилучшим результатом анализа рисков является перечень опасностей для технологической стадии, в которой существует какая-нибудь мера, способная улучшить качество продукции. Таким образом, если до начала анализа требуется присутствие «предпосылки», то после анализа опасностей появятся некие новые предпосылки – «оперативные предпосылки». Остается лишь несколько ККТ, для каждой из которых необходимо установить специальный контроль.
В руководстве по оценке рисками (ICHQ9 «Управление рисками для качества») особое внимание уделяется степени риска при производстве лекарственных препаратов на протяжении всего жизненного цикла продукции. Таким образом, используя связь между критическими параметрами качества (CQA-criticalqualityattribute) и рациональным подходом к оценке рисков, можно разработать внутренние операционные процедуры, например в качестве СОП.
На начальном этапе перечень потенциальных параметров (оценка рисков) может быть весьма обширным, но в процессе углубленного изучения процесса может быть сужен, что позволит оптимизировать технологический процесс с высокой долей вероятности снижения рисков.
При анализе переменных, основываясь на вероятности, серьезности и способности к их обнаружению, используются анализ видов режима отказа (FMEA – FailureModeandEffectsAnalysis) или аналогичные инструменты, которые базируются на первоначальных базах данных и исходных экспериментальных результатов фармацевтической разработки [9].
Наиболее распространенным инструментом анализа оценки рисков может служить диаграмма Ишикавы («Рыбий скелет»). Диаграмма Ишикавы (рис. 1) за счет своей незамкнутости позволяет решить в процессе производства задачи повышения качества разработанного нами стоматологического геля.
Анализ диаграммы Ишикавы наглядно показывает, что причинами возникновения возможных рисков производства стоматологического геля являются: исходное сырье, используемое оборудование, этап получения лекарственной формы, технологические и биофармацевтические факторы и валидация процесса.
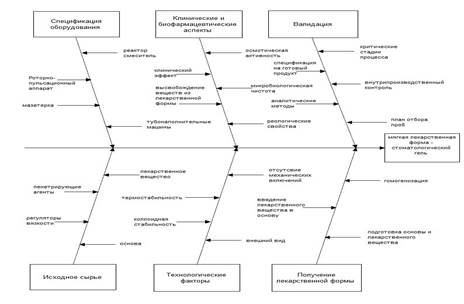
Рис. 1. Диаграмма Ишикавы
На качество стоматологического геля оказывает влияние не только природа вспомогательных веществ, но и их количество. Вспомогательные вещества могут в значительной степени влиять на фармакологическую активность лекарственных веществ, терапевтическую эффективность и качество лекарственных препаратов.
Выбранные вспомогательные вещества, их концентрации и характеристики, которые могут оказать влияние на действие лекарственного препарата или возможности производства, следует обсудить в отношении соответствующей функции каждого вспомогательного вещества. Такое обсуждение должно включать все вещества, используемые в производстве лекарственного препарата независимо от того, появятся они в конечном продукте или нет. Также должна быть установлена совместимость одних вспомогательных веществ с другими.
Нами была дана оценка коллоидной стабильности. В результате установлено, что гель стабилен, так как после центрифугирования при частоте вращения 2000 с-1 в течение 5 мин расслоения не наблюдается.
Одним из вспомогательных веществ в мягкой лекарственной форме является основа. Основа мягкой лекарственной формы обеспечивает требуемую концентрацию лекарственных веществ, необходимые консистентные свойства лекарственной формы и влияет на высвобождение лекарственных веществ из лекарственной формы [7].
При оценке термостабильности установлено, что образцы оставались однородными без расслоения.
Выбор мазевых основ зависит от цели, места и характера действия лекарственной формы, а также от физико-химических свойств лекарственных веществ. Мазевая основа не должна менять pH кожи, должна хорошо воспринимать лекарственные вещества различного агрегатного состояния, быть химически индифферентной, стабильной в процессе хранения, устойчивой к воздействию микроорганизмов, иметь соответствующую консистенцию [7].
При изучении структурно-механических характеристик исследуемый гель обладает в изучаемом диапазоне скоростей более выраженными значениями вязкости, т.е. при увеличении скорости сдвига от 12 до 80 с-1 вязкость падает от 26,33 Pa/c до 9,15 Pa/c. При этом также характерно, что вязкость состава снижается при возрастании скорости сдвига. При анализе площади петли гистерезиса (рис. 2) можно сделать вывод о том, что данная структура восстанавливается в течение 15–20 мин.
Для мягких лекарственных форм имеет большое значение способ введения лекарственных веществ в основу. Способ введения зависит от физико-химических свойств и количественного содержания лекарственных веществ, так как это обусловливает эффективность препарата.
Также была дана оценка показателям внешний вид (прозрачность). По результатам анализа разработанный нами стоматологический гель представляет собой прозрачную однородную умеренно вязкую массу без цвета и запаха.
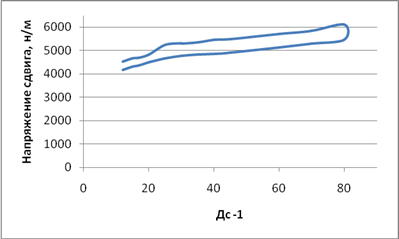
Рис. 2. Реологическая кривая течения стоматологического геля
Значимость технологических показателейстоматологического геля играет важную роль. Внешний вид лекарственной формы оказывает влияние на эмоциональное состояние больного и, следовательно, на эффективность лечения; механические включения могут привести к повреждениям слизистой полости рта, что может вызвать классическое раздражение, а также аллергические явления и токсико-химические изменения. Показатель коллоидной стабильности оказывает влияние на общую структуру геля, в том числе реологические показатели, что особенно важно как в самой технологии получения геля, так и при его применении, особенно с учетом явления тиксотропии [1].
При изучении технологических свойств стоматологического геля можно сделать вывод, что гель обладает удовлетворительными технологическими и биофармацевтическими свойствами, что позволяет рекомендовать его к применению в стоматологии. При разработке технологии стоматологического геля с учетом требований фармацевтической разработки (ICHQ8) была дана оценка следующим критическим контрольным точкам: технологические и биофармацевтические факторы. Значимость данных критических контрольных точек играет важную роль при производстве стоматологического геля, так как удовлетворительные технологические и биофармацевтические свойства мягкой лекарственной формы определяют эффективность препарата при его применении.
Валидация технологического процесса на стадии фармацевтической разработки – обязательная процедура. Валидация должна документально подтверждать его пригодность для получения продукта надлежащего качества и надежность, т.е. постоянное воспроизведение процесса с заданными параметрами и продукта с заданным качеством. Фиксируются показатели качества продукта и важнейшие параметры процесса, которые не должны значительно изменяться на последующих этапах жизненного цикла лекарства. Валидация представляет доказательства надежности процесса, которые наряду с другими сведениями формируют в регистрационном досье необходимый объем информации, характеризующей свойства данного продукта и процесса.
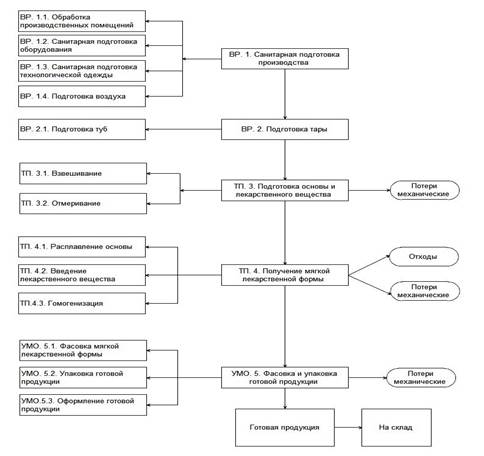
Конструкция реакторов, фильтров, смесителей и другого оборудования для производства мягких лекарственных форм, а также их отдельных компонентов должна обеспечивать максимальную чистоту получаемого продукта. С этой целью конструкторы пытаются избавить систему от «мертвых зон», в которых продукт может застаиваться и вызывать контаминацию, а также обеспечивает максимальную наглядность загрязнений и эффективность очистки оборудования. В результате проведенного исследования нами предложена технологическая схема производства стоматологического геля.
Комплексный анализ технологической схемы производства и диаграммы Ишикавы показал, что наибольший риск может наблюдаться на стадиях: подготовки основы и лекарственного вещества, введения лекарственного вещества в основу, гомогенизации и фасовки. Для определения контрольных точек производства в деле оценки качества стоматологического геля нами предложены следующие критерии, представленные в таблице 1.
Таблица 1
Контрольные точки производства
|
Контрольные точки производства |
|||||
|
Контроль температуры |
Количество компонентов |
Скорость перемешивания и гомогенизации |
Продолжительность производственных стадий |
Количественный анализ компонентов |
Масса дозы |
|
Приготовление основы |
Приготовление основы |
Приготовление основы |
Приготовление основы |
- |
- |
|
Добавление действующих веществ |
Добавление действующих веществ |
Добавление действующих веществ |
- |
- |
- |
|
Добавление последующих компонентов |
Добавление последующих компонентов |
Добавление последующих компонентов |
- |
- |
- |
|
Гомогенизация |
- |
Гомогенизация |
Гомогенизация |
Количественный анализ |
- |
|
Фасовка |
- |
- |
- |
- |
Масса дозы фасовки |
|
Момент либо повод для документирования |
|||||
Технологическая схема производства стоматологического геля
Выводы
Проведены исследования по разработке технологии стоматологического геля с учетом требований, изложенных в ICHQ8 «Фармацевтическая разработка» и ICHQ9 «Управление рисками для качества». Были разработаны диаграмма Ишикавы и технологическая схема производства стоматологического геля. Комплексный анализ разработанной диаграммы и технологической схемы производства дает возможность выделить контрольные критические точки, позволяющие нам минимизировать возникновение возможных рисков производства стоматологического геля.
По результатам исследований технологических и биофармацевтических факторов можно сделать вывод о том, что разработанный стоматологический гель обладает удовлетворительными технологическими и биофармацевтическими свойствами, что позволяет рекомендовать его к применению в стоматологии.
Рецензенты:
Пантюхин А.В., д.фарм.н., доцент, зав. кафедрой фармацевтической технологии и биотехнологии ГБОУ ВПО «Саратовский ГМУ им. В.И. Разумовского» Минздрава России, г. Саратов;
Петров А.Ю., д.фарм.н., к.хим.н., зав. кафедрой фармации ГБОУ ВПО «УГМУ Минздрава России», г. Екатеринбург.



