Особым разделом современной травматологии и ортопедии является лечение ложных суставов длинных костей на фоне иммобилизационного остеопороза (ИОП), развивающегося вследствие длительного дефицита весовой и динамической нагрузок поврежденной конечности после травмы [3]. Число таких пациентов в последние годы постоянно увеличивается [7].
Оперативное лечение пациентов с несращениями костей на фоне ИОП в связи со сниженной механической прочностью костной ткани сопровождается резорбцией в зоне её контакта с фиксатором [1], увеличением подвижности его при динамических нагрузках с последующей миграцией, формированием нестабильности, рефрактур или вторичных деформаций [9; 10 и др.]. При ИОП увеличивается длительность нетрудоспособности, возрастает число неблагоприятных исходов лечения [4].
Для оптимизации исходов лечения пациентов на фоне ИОП применяются различные модификации фиксаторов и оперативных технологий [7; 8 и др.], хирургические вмешательства сочетают с медикаментозными средствами или воздействием физических факторов, способствующих активизации остеогенеза [2; 3].
В современной научной литературе большое внимание уделяется изучению биоактивных и биоинертных покрытий металлических фиксаторов, уменьшающих негативное влияние металла на окружающие ткани, активизирующих остеорепарацию [5]. Однако исследования в основном касаются имплантатов для постоянного использования [6], данные об использовании покрытий для временных (удаляемых) имплантатов до сих пор малочисленны.
Цель исследования – изучить в эксперименте морфоструктурные особенности реакции остеопоротически перестроенной кости на введение стандартных металлофиксаторов и фиксаторов с алмазоподобным (DLC) покрытием.
Материалы и методы. В исследовании использовались 80 самцов крыс Вистар в возрасте 3-4 месяцев, массой 100-200 г. Все опыты проводились согласно «Правилам проведения работы с использованием экспериментальных животных» (приложение по приказу МЗ СССР № 755) и Европейской конвенции защиты животных, принятой в 1986 году в Страсбурге. Животные разделены на две серии по 40 особей в каждой. Оперативные пособия проводились под внутримышечным наркозом. Всем животным предварительно моделировали ИОП, ампутируя 1/3 голени одной из задних конечностей, что обеспечивало формирование её неопороспособности. Крысам обеих серий проведена имплантация спиц: 1 серия - спицы из медицинской стали d = 0,8 мм в область дистального метафиза бедренной и проксимального метафиза большеберцовой костей, 2 серия – спицы из медицинской стали d = 0,8 мм с алмазоподобным покрытием (DLC) по аналогичной схеме. Сроки наблюдения составили: 14, 30, 90, 120 дней после операции. Выведение из эксперимента проводилось согласно Международным правилам гуманного отношения к животным.
Экспериментальный материал представлял костные блоки бедренных и большеберцовых костей. Гистологические препараты окрашивали гематоксилин-эозином, по Ван Гизону. Изучение морфологического материала выполняли с использованием микроскопа Olimpus (Япония). Ввод изображений производили на цифровом модуле визуализации и документирования VIDI–CAM (Россия, СПб). Для анализа оцифрованных изображений использовали программное обеспечение «Видео – Тест Мастер – Морфология 5.2.» (Россия, СПб.). Различия сравниваемых показателей считали достоверными при p≤0,05.
Результаты исследования и обсуждение
Через 14 дней после имплантации спиц в первой серии к стенкам спицевого канала на отдельных участках прилегала капсула, сформированная из коллагеновых волокон различной степени зрелости (рис. 1А). В серии с DLC-покрытием стенка спицевого канала в этот срок состояла из костной ткани с участками тонкой фиброзной выстилки (рис. 1Б). Средняя объемная доля новообразованной костной ткани в стенке спицевого канала в первой серии составила 0,304 ± 0,00465, во второй – 0,350 ± 0,00316.
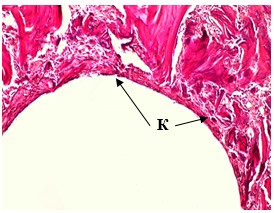
Рис. 1А. Микрофотография спицевого канала. 1 серия, 14 дней опыта. Гематоксилин - Эозин. Увеличение × 100 Формирование капсулы (К) на стенке спицевого канала.
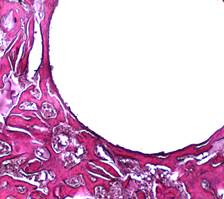
Рис. 1Б. Микрофотография спицевого канала. 2 серия, 14 дней опыта. Гематоксилин - Эозин. Увеличение × 100 Формирование тонкой фиброзной выстилки на стенке спицевого канала.
Через 30 дней после операции в костной ткани обеих серий сохранялись истонченные, атрофические трабекулы, характерные для остеопороза. В спицевых каналах у животных первой серии определялась утолщенная фиброзная капсула (рис. 2А), в прилежащей к спицевому каналу кости сохранялись дистрофические и очаговые склеротические изменения. Во второй серии стенка спицевого канала состояла из костной ткани с фрагментами фиброзной выстилки, аналогичной по структуре предыдущему сроку (рис. 2Б). Показатель средней объемной доли новообразованной костной ткани в первой серии составил 0,291 ± 0,0035, во второй – 0,423 ± 0,00319.
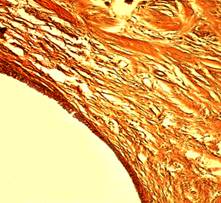
Рис. 2А. Микрофотография спицевого канала. 1 серия, 30 дней опыта. Ван Гизон. Увеличение × 100. Утолщение капсулы, её разволокнение.
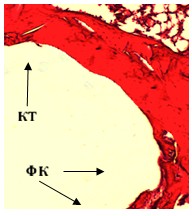
Рис. 2Б. Микрофотография спицевого канала. 2 серия, 30 дней опыта. Гематоксилин - Эозин. Увеличение × 100. Стенка канала состоит из костной ткани (КТ) с фрагментами фиброзной капсулы (ФК).
Через 90 дней наблюдения фиброзная капсула 1 серии была представлена упорядоченными зрелыми коллагеновыми волокнами (рис. 3А) с участками новообразованной незрелой костной ткани, признаками ИОП: истонченными костными трабекулами и расширенными межтрабекулярными пространствами. В серии с использованием спиц с DLC-покрытиями стенка спицевого канала состояла из костной ткани с прилежащими полями компактной и новообразованной губчатой ткани. Фиброзная капсула в спицевом канале в этой серии отсутствовала (рис. 3Б). Средняя объемная доля новообразованной костной ткани в стенке спицевого канала в первой серии составила 0,267±0,0043, во второй серии – 0,430±0,00357.
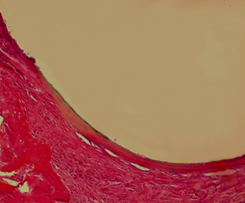
Рис. 3А. Микрофотография спицевого канала. 1 серия, 90 дней опыта. Гематоксилин - Эозин. Увеличение × 100. Фиброзная капсула на стенке спицевого канала.
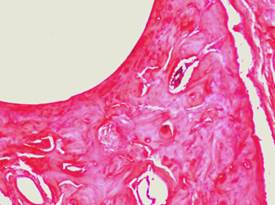
Рис. 3Б. Микрофотография спицевого канала. 2 серия, 90 дней опыта. Гематоксилин - Эозин. Увеличение × 100. Стенка спицевого канала представлена костной тканью.
Через 120 дней стенки спицевого канала животных обеих серий были представлены костью компактного строения. Отдельные фрагменты уплотненной фиброзной капсулы определялись на стенках спицевого канала в 1 серии. Во второй серии спицевой канал, так же как в 90 дней, имел стенку, состоящую из костной ткани. Фиброзная капсула в спицевом канале отсутствовала.
При морфологическом исследовании ткани, расположенной на стенках спицевого канала, в первой серии эксперимента отмечено формирование фиброзной капсулы в спицевом канале, что является характерным для внедрения любого инородного тела или материала в кость. Во второй серии опытов фиброзная капсула в спицевом канале отсутствовала, что свидетельствует об инертности алмазоподобного покрытия, отсутствии реакции костной ткани на его внедрение. Сохранение во второй серии (DLC) диаметра спицевого канала неизмененным в течение всего опыта свидетельствует об отсутствии резорбтивных процессов на границе «кость-спица». К завершению эксперимента (120 дней) у животных обеих серий в окружающем спицевом канале костной ткани сохранялись явления остеопороза. Остальные морфологические признаки были аналогичны сроку 90 дней наблюдения.
Результаты экспериментального морфологического исследования показали, что при ИОП вокруг имплантированной спицы у животных первой серии формировалась фиброзная капсула, толщина которой на протяжении эксперимента постепенно увеличивалась (рис. 4), прогрессировали резорбтивные процессы с увеличением диаметра спицевого канала (рис. 5). У животных второй серии (спицы с DLC-покрытием) признаки полноценной капсулы не определялись на протяжении всего эксперимента (рис. 4), а диаметр спицевого канала достоверно сохранялся на исходном уровне (рис. 5) в течение всего срока наблюдения.
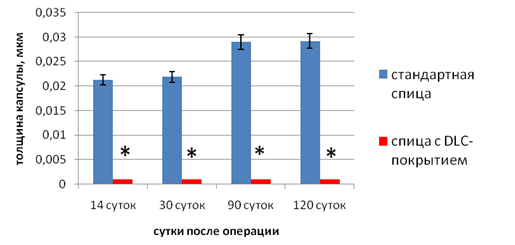
Рис. 4. Динамика изменений толщины капсулы (мкм) в спицевом канале. * р≤0,05 относительно первой серии.
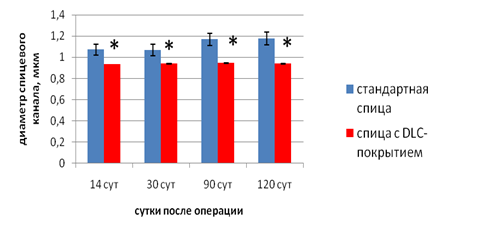
Рис. 5. Динамика изменений диаметра спицевого канала (мкм). * р≤0,05 относительно первой серии.
Анализ динамики изменений показал, что у животных первой серии после имплантации стандартных спиц явления остеопороза прогрессировали: увеличилось число участков пазушной и остеокластической резорбции, истонченных костных трабекул, расширенных межтрабекулярных пространств с прогрессирующим снижением показателя средней объемной доли костной ткани. Во второй серии опытов морфологические признаки прогрессирования ИОП отсутствовали, что подтверждается достоверным увеличением показателя объемной доли новообразованной костной ткани в стенке спицевого канала в процессе эксперимента (рис. 6).
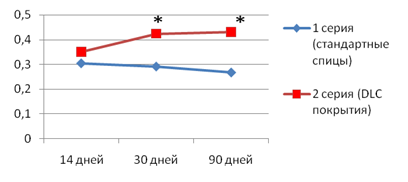
Рис. 6. Динамика изменения средней объемной доли новообразованной костной ткани в стенке спицевого канала. * р≤0,05 относительно первой серии.
Заключение
Морфологические изменения, развивающиеся при ИОП в зоне «кость - имплантат», принципиально отличались в опытных сериях. У животных с имплантацией стандартных спиц явления остеопороза активизировались, прогрессировало увеличение диаметра спицевого канала. Использование спиц с DLC-покрытием не вызывало прогрессирования ИОП. Формирование фиброзной капсулы в спицевом канале у животных было отлично только в первой серии. У животных с имплантацией спиц с DLC-покрытием фиброзная капсула в спицевом канале отсутствовала, что свидетельствовало об отсутствии типичной реакции костной ткани на введение спицы. Увеличение показателя объемной доли новообразованной кости в спицевом канале при имплантации спиц с DLC-покрытием можно рассматривать как остеоиндуктивное влияние этого покрытия на костную ткань.
Рецензенты:
Волокитина Е.А., д.м.н., профессор кафедры ФПК и ПП ГБОУ ВПО «УГМУ» Минздрава России, г. Екатеринбург;
Данилова И.Г., д.б.н., заведующая лабораторией морфологии и биохимии Института иммунологии и физиологии УрО РАН, г. Екатеринбург.



