Цель данной работы – сравнительное изучение влияния бетулина и механоактивированного композита бетулина с полиэтиленгликолем на выживаемость крыс при острой почечной недостаточности.
Методика исследования
В эксперименте использовали половозрелых самцов крыс линии Вистар полученных из сертифицированного питомника, прошедших карантин в течение 10 дней, массой 300-320 г.
Состояние ОПН вызывали хирургическим удалением почек в один этап. В качестве энтерального протектора использовали бетулин, полученный по оригинальной методике [4], и порошок механоактивированного (МА) композита бетулина с ПЭГ (соотношение бетулина к ПЭГ составляло 1:9, по массе), полученного путём механической активации в мельнице Spex 8000 (США) [9].
Были сформированы следующие группы животных: 1-ая группа включала 10 интактных крыс, содержавшихся ad libidum на стандартном рационе; 2-ая и 3-я группы – по 10 крыс с экспериментальной моделью ОПН, при содержании которых использовано пероральное введение 0,9% раствора NaCl (контроль 1); в 4-ой группе совместно с 0,9% раствором NaCl вводили бетулин (250 мг/кг), в 5-ой и 6-ой группах– совместно с 0,9% раствором NaCl вводили МА композит бетулина с ПЭГ (150 мг/кг), в 7-ой группе совместно с 0,9% раствором NaCl вводили 100 мг/кг ПЭГ (контроль 2). Данные о выживаемости крыс, принадлежащих ко 2-ой, 4-ой и 5-ой группам, применены в актуариальных расчётах. Крысы 3-ьей и 6-ой групп были предназначены для биохимических и физико-химических исследований.
Порошок бетулина вводили крысам в желудок ежедневно в дозе из расчета 250 мг/кг с помощью зонда. Дозу подбирали с учетом проведенных ранее экспериментальных работ с применением бетулина у крыс и исследований его острой токсичности [3]. Учитывая большую, чем у бетулина, растворимость МА композита бетулина с ПЭГ, композит вводили крысам в половинной дозе от дозы бетулина (из расчета 150 мг/кг). Продолжительность жизни нефрэктомированных крыс оценивали путём построения кривых дожития по данным первичных протоколов, составленных в соответствии с «моментным» методом E.Kaplan-P.Meier [9]. Биохимические исследования проводили в отдельных экспериментах, в которых состояние острой почечной недостаточности моделировали вышеуказанным способом. Забор крови осуществляли в соответствии с принципом «наблюдение доживших до анализируемого интервала», что, согласно расчётам, предписывало брать образцы на вторые и третьи сутки с момента удаления почек. Для биохимических исследований собирали кровь после декапитации, из которой стандартным способом получали плазму. Для физико-химических исследований брали кровь из правого желудочка сердца с доступом посредством торакотомии с помощью гепаринизированных игл и шприцов. Биохимические показатели плазмы и физико-химические свойства крови изучены с применением сертифицированных анализаторов на базах клинических лабораторий. Хирургические манипуляции, включая забор образцов крови, а также эвтаназия, выполнены у крыс, находившихся в состоянии эфирного наркоза с учётом норм Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях (Страсбург, 18.03.1986 г.) и Приказа МЗ РФ №267 от 19.06.2003 г. «Об утверждении правил лабораторной практики». Статистическую обработку проводили по общепринятой методике с использованием t-критерия Стьюдента.
Результаты исследования
Среднее время продолжительности жизни животных при введении бетулина и МА композита бетулина с ПЭГ в сравнении с контрольной группой приведено в таблице 1.
Таблица 1
Средняя продолжительность жизни крыс с моделью ОПН при введении бетулина, МА композита бетулина с ПЭГ и ПЭГ (р = 0,95, n = 10)
|
Группа животных
|
Группа 2 (контроль 1) |
Группа 4 |
Группа 5 |
Группа 7 (контроль 2) |
|
Продолжительность жизни, мин |
5087 ± 1009 |
7411 ±1395 |
10137 ±1256 |
4545 ± 2930 |
Из приведенных данных видно, что увеличение средней продолжительности жизни нефрэктомированных крыс, которым давали бетулин, выше, чем у контрольной группы, получавшей физиологический раствор, и составляла 38 ч 44 мин (2324 мин), а у нефрэктомированных крыс, получавших МА композит бетулина с ПЭГ, соответствовала 79 ч 09 мин (4545 мин), что почти в 2 раза превышало показатель для группы, получавшей чистый бетулин. Средняя продолжительность жизни крыс в группе 7, принимавших ПЭГ (контроль 2), практически не отличалась от контроля 1.
Данные о выживаемости животных с моделью ОПН при введении бетулина и композита бетулина с ПЭГ представлены графически на рис. 1. Установлено, что максимальная продолжительность жизни нефрэктомированных крыс в экспериментальных группах достигает 7 суток, что, по-видимому, является биологическим пределом выживаемости при ОПН для данного вида животных. На кривых для нефрэктомированных крыс при введении бетулина и МА композита бетулина с пэг наблюдаются перегибы. Это означает, что под влиянием бетулина включаются иные, нежели в обычных условиях, физиологические механизмы, которые увеличивают выживание при ОПН. Прежде всего, это проявляется в ранние сроки данной ургентной патологии. В частности, фактическая выживаемость нефрэктомированных крыс, содержавшихся на рационе с бетулином, остаётся на уровне 100% в интервале вплоть до 70 часов. При этом количество выживших нефрэктомированных крыс, содержавшихся на стандартном рационе, в этом же временном интервале не превышает 70%. В свою очередь, 70%-ная выживаемость нефрэктомированных крыс, получавших бетулин, смещена к 120 часам. Таким образом, показатели динамики выживаемости и объема выживших нефрэктомированных крыс, принимавших бетулин, почти в два раза превышают соответствующие показатели нефрэктомированных крыс контрольной группы, принимавших физиологический раствор.
Выживаемость нефрэктомированных крыс, принимавших МА композит бетулина с ПЭГ, остаётся на уровне 100 % вплоть до 100 часов, а 70%-ная выживаемость смещена к 160 часам. Данные показатели превышают показатели по выживаемости крыс, принимавших чистый бетулин (рис. 1).
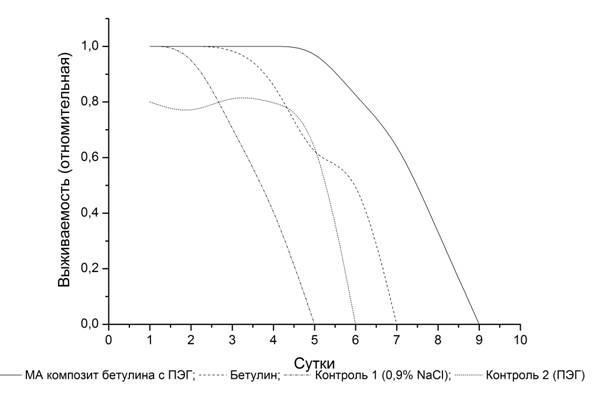
Рис. 1. Кривые дожития нефрэктомированных крыс с моделью ОПН при введении бетулина и МА композита бетулина с пэг в сравнении с контролем. Подписи к кривым даны на рисунке
По данным биохимических исследований композит бетулина с ПЭГ, как в условиях физиологической нормы, так и при ОПН, значимого влияния на концентрацию креатинина в плазме крови не оказывает (табл. 2). Однако под воздействием композита бетулина в условиях физиологической нормы уже в первые сутки существенно увеличивается концентрация мочевины в плазме крови. Эффект гиперкарбамадемии, индуцированный композитом бетулина, сохраняется и при почечной недостаточности. Механизм этого явления пока неизвестен. Учитывая, что стабильность молекул мочевины в значительной мере определяется концентрацией ионов водорода, при уменьшении которых молекулы мочевины становятся более стабильными, нами выдвинута гипотеза, согласно которой увеличение концентрации мочевины обусловлено ощелачивающим действием композита бетулина, связанным со способностью реагировать с кислотами как бетулина, так и ПЭГ.
Таблица 2
Влияние МА композита бетулина с ПЭГ на биохимические показатели крови нефрэктомированных крыс (M±m)
|
Показатель |
Контрольная группа 3 |
Опытная группа 6 |
|
Общий белок, г/л |
44,65±1,5 |
41,96±1,41 |
|
Альбумин |
23,4±1,4 |
21,1±0,6 |
|
Сахар, ммоль/л |
6,47±0,05 |
4,28±0,17 |
|
Мочевина, ммоль/л |
17,6±0,2 |
20,02±0,46 |
|
Креатинин, ммоль/л |
1,1±0,2 |
1,0±0,1 |
|
Билирубин, мкмоль/л |
9,7±1,0 |
10,2±0,6 |
|
АСТ, е/л |
210,65±26,59 |
208,55±21,38 |
|
АЛТ, е/л |
185,17±32,47 |
75,32±6,95 |
|
Щелочная фосфатаза |
148,58±14,44 |
101,98±3,4 |
|
Амилаза, е/л |
548,17±14,48 |
549,7±26,81 |
|
Кальций, ммоль/л |
2,1±0,2 |
2,2±0,2 |
Для проверки этой гипотезы были изучены параметры кислотно-щелочного баланса. Полученные результаты свидетельствуют, что композит бетулина не влияет на рН плазмы крови, как в группе животных без модели ОПН, так и при почечной недостаточности. Влияние композита бетулина на парциальное давление газов в плазме крови неоднозначно. Так, в условиях нормы (не оперированная группа животных) парциальное давление углекислого газа растёт, а при почечной недостаточности, наоборот, существенно уменьшается (табл. 3). В группе животных без ОПН под воздействием композита бетулина парциальное давление кислорода падает, а при почечной недостаточности достоверно возрастает. Столь же неоднозначное воздействие композит бетулина оказывает и на показатели концентрации карбонатов. В условиях нормы (не оперированные животные) концентрация актуальных карбонатов увеличивается, а при почечной недостаточности, наоборот, уменьшается. Более стабильно бетулин действует в отношении лактата – концентрация этого метаболита в референтных группах достоверно уменьшается. Разнонаправленное поведение композита бетулина в условиях нормы (без ОПН) и при почечной недостаточности может быть связано с тем, что молекулы бетулина и ПЭГ содержат гидроксильные группы, которые могут выступать и как доноры, и как акцепторы протонов. При этом эффекты, вызванные бетулином, определяются исходным физико-химическим фоном.
Таблица 3
Влияние МА композита бетулина с ПЭГ на физико-химические показатели крови нефрэктомированных крыс (M±m)
|
Показатель |
Контрольная группа 3 |
Опытная группа 6 |
|
pH |
6,81±0,04 |
6,89±0,04 |
|
pCO2 |
68,32±1,39 |
51,6 ±3,55 |
|
pO2 |
18,87±1,28 |
21,3 ±0,61 |
|
cBase, ммоль/л |
-20,8±0,6 |
-22,6±0,32 |
|
cLac, ммоль/л |
8,47±1,32 |
5,96±0,97 |
Необходимо учесть, что большую часть времени кишечного транзита исследуемые препараты находятся в щелочной среде. Длительное пребывание композита бетулина в щелочной среде тонкого кишечника в условиях физиологической нормы может выступить фактором, который способствует последующему взаимодействию бетулина с протонами. При почечной недостаточности композит бетулина оказывает выраженное воздействие на кислотность, обусловленную обменом молочной кислоты. В ситуации острой почечной недостаточности, т.е. при повышенной кислотности среды, композит бетулина снижает концентрацию лактата и усиливает оксигенацию крови.
Таким образом, представленные результаты свидетельствуют о достаточно высокой биологической активности бетулина и, в большей степени, механоактивированного композита бетулина с ПЭГ, обладающего лучшей растворимостью, на животных с ОПН. Композит бетулина с ПЭГ ощелачивают плазму крови, вызывая состояние, близкое к компенсированному метаболическому алкалозу, что можно использовать для коррекции кислотно-щелочного баланса, например, при метаболических наклонностях к образованию кислых камней. В условиях почечной недостаточности путём уменьшения концентрации молочной кислоты появляется возможность сдержать натиск лактоацидоза, уменьшив, тем самым, объем полиорганной деструкции.
Работа выполнена при поддержке Федеральной целевой программы «Исследования и разработки по приоритетным направлениям развития научно-технологического комплекса России на 2014-2020 г.» (пр. RFMEFI60714X0031).
Рецензенты:Зайцева О.И., д.м.н., профессор, главный научный сотрудник лаборатории клинической патофизиологии Федерального государственного бюджетного научного учреждения «научно-исследовательский институт медицинских проблем севера», г. Красноярск;
Новицкий И.А., д.м.н., профессор кафедры фармакологии с курсами клинической фармакологии, фармтехнологии и ПО, ГБОУ ВПО "Красноярский государственный медицинский университет имени профессора В.Ф. Войно-Ясенецкого" Министерства здравоохранения Российской Федерации, г. Красноярск.



