В современном мире одно из ведущих мест среди причин смертности и инвалидизации населения принадлежит инсультам. Исходя из этого, своевременная профилактика инсультов является не только медицинской, но и социальной проблемой.
В Казахстане принята и реализуется Государственная программа развития здравоохранения на 2011–2015 гг. «Саламатты Казахстан». В рамках этой программы проводятся масштабные скрининговые обследования населения по выявлению различных заболеваний, в частности сердечно-сосудистых.
Сердечно-сосудистые заболевания (ССЗ) – это группа болезней сердца и кровеносных сосудов, к которой относятся: гипертония, ишемическая болезнь сердца, заболевания периферических сосудов, сердечная недостаточность. Одна из наиболее весомых патологий, относимых к ССЗ, – это нарушение мозгового кровообращения (инсульт) [5].
Общая смертность при инсультах в России составляет 1,28 на 1000 населения. Общая летальность у больных с инсультом составляет 40,3%. Инвалидность с потерей трудоспособности, по разным данным, варьирует от 40 до 80% [8]. Изучение динамики заболеваемости за последние десятилетия указывает на существование стойкой тенденции к росту, который составляет 0,5–1% в год [2]. В Финляндии ежегодно испытывают нарушение мозгового кровообращения 0,2% населения [3]. В США регистрируется увеличение возникновения острого нарушения мозгового кровообращения, несмотря на популяризацию здорового образа жизни и развитую систему здравоохранения [9].
В настоящее время заболеваемость инсультами в Карагандинской области достигает 10,02% [6]. Инсульт является многофакторным заболеванием. Одни факторы риска определяют предрасположенность, а другие запускают механизм ее развития. Комбинации факторов риска в каждом случае индивидуальны [6].
В Казахстане тысячи пациентов больны сахарным диабетом, атеросклерозом, артериальной гипертензией, поэтому значимую роль сыграет профилактическая стратегия высокого риска. Она подразумевает под собой отбор группы лиц, имеющих высокий риск возникновения инсульта. Однако для ее эффективного применения необходимы знание факторов риска и наличие системы прогнозирования, которая позволяла бы не только выделить лиц, имеющих высокий риск возникновения острого нарушения мозгового кровообращения, но и определить для них наиболее рациональный и контролируемый путь его предупреждения.
Перспективным и экономически выгодным решением проблемы инсульта являются разработка скрининговой методики, прогнозирующей вероятность возникновения инсульта, и его своевременная профилактика. Скрининговая методика должна применяться врачами общей практики, участковыми врачами, в центрах профилактики инсульта, так как к невропатологам пациенты попадают уже с отчетливой симптоматикой нарушения мозгового кровообращения.
В Карагандинской области функционируют центры профилактики инсульта, в которых проводятся информирование населения о факторах риска острого нарушения мозгового кровообращения, обучение корректному поведению при острой неврологической симптоматике, формирование здорового образа жизни. Внедрение скрининговой методики в центры профилактики инсульта является важной задачей. В этом случае в центрах будет реализовываться не только первичная профилактика, но и вторичная, которая подразумевает поиск пациентов с высоким уровнем вероятности инсульта.
На данный момент в поликлиниках Казахстана началось внедрение электронных карт пациента. В связи с этим наиболее удобным способом использования скрининговой методики являются разработка на ее основе компьютерной программы и создание комплекса «электронная карта — прогностическая программа». Это позволит определять риск возникновения инсульта пациента при прохождении обследований и контролировать его показатели на протяжении времени. При этом необходимы более глубокие исследования для лиц с метаболическим синдромом как для группы, сочетающей в себе многие факторы риска ССЗ и, по данным MichielSala и соавторов, имеющей бессимптомное повреждение головного мозга [10].
Целью исследования явилось создание скрининговой методики позволяющей выявлять пациентов с высокой вероятностью возникновения инсульта.
Материалы и методы исследования. На первом этапе исследования была разработана методика прогнозирования инсульта. Для этого в исследование были включены 156 участников в возрасте от 40 до 83 лет с равным количеством мужчин и женщин [8]. Первая группа – 32 пациента с острым нарушением мозгового кровообращения по ишемическому типу. В группу больных с сахарным диабетом включены 94 пациента, имеющих сахарный диабет в компенсаторной стадии, инсульт за текущий год у 9 человек. Контрольную группу составили 30 практически здоровых людей, сопоставимых по возрасту и полу. Критериями включения в контрольную группу были возраст от 40 до 80 лет, нормальное артериальное давление, ИМТ в пределах 18,5–25,0, показатели биохимического анализа крови и аппаратных методов диагностики, соответствующие относительной норме.
Проводилось анкетирование всех участников исследования. В анкете представлены вопросы на выявление факторов риска.
Были проведены следующие измерения: индекс массы тела (ИМТ), систолическое артериальное давление (САД) и диастолическое артериальное давление (ДАД), частота дыхательных движений (ЧДД) и частота сердечных сокращений (ЧСС), определение уровня глюкозы крови (в этом и других анализах) утром натощак в стандартных условиях. Гликозилированный гемоглобин определялся иммунологическим методом при помощи реагентов Vital и спектрофотометра DR 2800 с длиной волны 443 нм. Исследования свертывающей системы крови (ПТИ, количество фибриногена, агрегация тромбоцитов, АПТВ) проводились на одноканальном анализаторе параметров гемостаза Clot-1. Для определения биохимических показателей крови (холестерина, триглицеридов, АЛАТ, АСАТ, общего билирубина, прямого билирубина, мочевины, креатинина, общего белка) использовались реагенты фирмы Vital с биохимическим анализатором BioSystemA-15. ЭКГ исследование проводилось в 12 отведениях на электрокардиографе BTL-088D, Великобритания 2011, а ЦДК б/ц ствола проводилось сканером MEDISON SONOACE X8. Линейный датчик 5–12 мГц.
Следующим этапом явилась статистическая обработка измерений, которую проводили согласно общепринятым методам в программе Statistica 6.1. Для получения коэффициентов корреляции была создана квадратная корреляционная матрица. Распределения параметров подчинялись нормальному закону распределения.
Исследование включало как качественные, так и количественные признаки, поэтому появилась необходимость создания матрицы с закодированными значениями. Определялся максимум и минимум изучаемого фактора, полученный интервал разбивался на необходимое количество пронумерованных интервалов (количество и размер интервалов определялись исследователем согласно нормальным значениям показателей, а также частоте появления значений в интервале).
Событие (инсульт) в матрице — зависимая переменная и кодировалось 1 и 0. Остальные же факторы риска явились независимыми переменными и кодировались в зависимости от количества интервалов у данного фактора.
Для ЦДК выделили следующие наиболее часто встречающиеся критерии у участников исследования: атеросклероз сонной артерии, повышение периферического сопротивления в сонных артериях, деформация позвоночных артерий, компрессия позвоночных артерий, ускорение кровотока в бассейне позвоночных артерий, норма. Для ЭКГ критериями выступили следующие данные: аритмия, тахикардия, экстрасистолия, нарушение проводимости, нарушение реполяризации, норма. При наличии признака ячейке присваивалось значение 1, при отсутствии — 2.
На втором этапе для проверки гипотезы о бессимптомном повреждении головного мозга у пациентов с МС были отобраны 39 пациента с МС и 80 пациентов с ишемическим инсультом. У них определялись нейроспецифические маркеры: нейронспецифическая енолаза (НСЕ), глиальный фибриллярный протеин (GFAP) и матриксная металлопротеиназа (MMP-9). Маркеры были включены как наиболее изученные в диагностическом и прогностическом отношении, с целью характеристики повреждения церебральной ткани и дисфункции ГЭБ у участников исследования.
Забор проб крови на лабораторные анализы проводился у всех больных из локтевой вены натощак в стандартных условиях. Биохимические исследования крови проводились в лаборатории Центра Первичной Медико-Санитарной Помощи № 2 с обязательным внешним и внутренним контролем. Анализ крови проводился на биохимическом анализаторе BioSystemA-15 с использованием реагентов фирмы Vital. Определение маркеров НСЕ, GFAP и ММР-9 проводилось в Лаборатории Коллективного Пользования (ЛКП) Карагандинского Государственного Университета. Кровь собиралась вакуумными системами Vacutainer с гелем для отделения сыворотки. После забора кровь в первый час центрифугировалась и транспортировалась в ЛКП для дальнейшего исследования. Лизированные образцы исключались из исследования. Для определения маркеров использовались следующие наборы реагентов: NSE ELISA (Fujirebio), Human GFAP ELISA (BioVendor), Human MMP-9 ELISA(BenderMedSystems). Иммуноферментный анализ проводился на роботе TecanEvolizer 100. Результаты оценивались: для НСЕ в мкг/л, для GFAPи ММР-9 в нг/мл.
Результаты и обсуждение. Для первого этапа исследования анализ корреляционных связей проводился для двух групп:
1) участники с произошедшим инсультом и участники контрольной группы;
2) пациенты с СД с относительно нормальными показателями для обозначения минимальной вероятности возникновения инсульта и пациенты с СД с произошедшим инсультом.
В первой группе мы наблюдаем тесную зависимость инсульта от таких факторов, как: повышенный индекс массы тела, длительность АГ, повышение САД, ДАД, ЧСС, изменение показателей мочевины и креатинина. Самым тесно коррелируемым признаком из всех рассмотренных является количество фибриногена. Длительность АГ тесно коррелирует с гликозилированным гемоглобином.
Во второй группе значимая теснота корреляции присутствует между событием инсульта и длительностью АГ и СД. Между факторами «длительность заболевания СД» и «длительность АГ» существует значимый коэффициент корреляции. Столь большая разница в количестве коррелируемых факторов в разных группах обусловлена разными путями развития нарушения мозгового кровообращения у больных СД и пациентами, не имеющими данной патологии. Коэффициенты корреляции и регрессии приведены в ранее опубликованной работе [3].
Математический анализ основывался на методе логистической регрессии.
Математическая модель позволяет определить вероятность возникновения инсульта у пациента или тенденцию к возникновению инсульта в социальных группах, изучить характер изменения вероятности появления инсульта при изменении действующих факторов, оценить степень влияния исследованных факторов на величину вероятности, прогнозировать возникновение инсульта для заданных уровней факторов, определить оптимальные уровни факторов для обозначения желаемых или требуемых значений показателей.
Эта модель имеет вид:
y = exp(b0 + b1*x1 + ... + bi*xi)/{1 + exp(b0 + b1*x1 + ... + bi*xi)};
0<y<1,
Где: y — вероятность возникновения инсульта;
b0 — свободный член;
b1….bi — коэффициенты регрессии факторов х1…хi
В результате обработки получили коэффициенты регрессии сведенные в таблицу.
В качестве примера приведем уравнение регрессии для пациентов первой группы:
Y= EXP A/ 1+ EXP A,
Уравнение(1)
Где А= (0,394929 – 2,45497 + 10,56 + 2,7 + 5,056959 + 1,9506 + 1,127639 + 3,57748 – 5,67782 – 4,47648 – 11,1834 + 3,56 – 3,07065 + 2,31037 – 0,756821 – 1,28629 – 8,35471 + 1,99058 – 2,20222 + 6 – 7,56844 + 1,38996 – 5,99556 – 1,58150 – 2,31824 + 6,2482 – 11,0942 + 1,149431 – 0,581736 – 4,18548 + 0,658318 – 4,66957 + 9,98 – 1,63149 – 7,53494 + 1,785463)х(Х1 +…+ Х35).
Для определения вероятности наступления инсульта необходимо вместо Х1…Х35 подставить код интервала, которому принадлежат показатели. Также мы определили, что шансы развития инсульта в группе с СД в 2,08 раза выше, чем у участников без СД.
Критерии значимости составляли р =0,02038 при хи 2 =54,174 для второй группы, а для первой группы р =0,03683, при ![]() =51,352. Данные критерии значимости подтверждают работоспособность модели [1].
=51,352. Данные критерии значимости подтверждают работоспособность модели [1].
Выдвинутая авторами гипотеза о бессимптомном повреждении головного мозга у пациентов с МС подтвердилась на втором этапе исследования. Полученные результаты сейчас проверяются на воспроизводимость.
Проведенные исследования доказали перспективность данного направления.
Порядок применения скрининговой методики у пациентов приведен в блок-схеме (рис. 1).
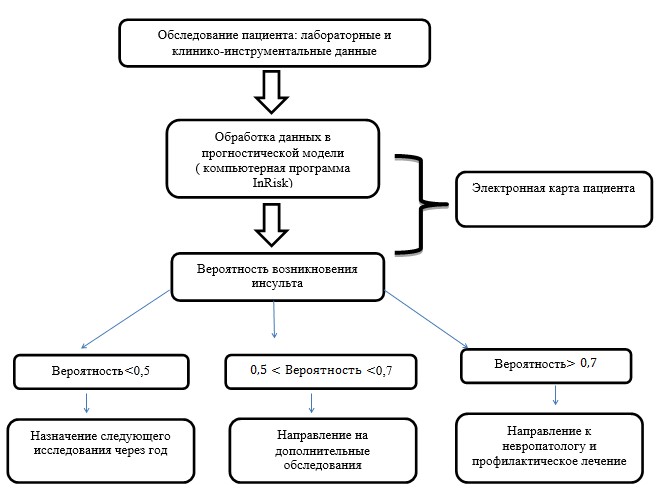
Рис. 1. Порядок применения скрининговой методики у пациентов
Обработка результатов второго этапа исследования с маркерами изменит предлагаемую блок-схему. Очевидно, что понадобятся выделение группы с МС и проведение дополнительных исследований.
Заключение
В результате применения полученной скрининговой методики будут достигнуты следующие эффекты.
1. Уменьшение смертности и инвалидизации вследствие острого нарушения мозгового кровообращения и увеличение продолжительности жизни населения.
2. Сокращение расходов на лечение и госпитализацию больных путем своевременного предотвращения инсульта.
3. Снижение заболеваемости мозговым инсультом.
Предполагается, что скрининговая программа должна быть обязательной процедурой для населения и ее результаты должны отражаться в электронной карте пациента.
Рецензенты:
Оспанова К.Б., д.м.н., профессор КГМУ, первый заместитель председателя «НурОтан» в Карагандинской области, г. Караганда;
Глотов Б.Н., д.т.н., декан дистанционного и заочного образования КрГТУ, г. Караганда.



