В настоящее время метаболическая патология костной ткани находится в сфере интересов врачей различных специальностей, представляя собой актуальную мультидисциплинарную проблему. Это обусловлено повсеместным распространением и высокой социальной и медико-экономической значимостью остеопороза (ОП), который экспертной оценкой ВОЗ отнесен к десяти наиболее важным заболеваниям [5]. Последствия ОП – повышенная инвалидизация и смертность населения и связанный с этим рост затрат системы здравоохранения, обусловлены прежде всего остеопоретическими переломами позвонков и периферических костей скелета [10]. Клиническая манифестация в виде переломов характерна для лиц старшей возрастной группы – пожилого и старческого возраста, однако ОП закладывается в раннем детстве различными нарушениями качественных и количественных характеристик костной ткани. При этом особая подверженность кости неблагоприятным влияниям отмечается в интенсивные, критические периоды костного ремоделирования, в том числе в период набора максимальной костной плотности в молодом возрасте [2]. Низкую минеральную плотность костной ткани (МПКТ), определяемую с помощью двухэнергетической рентгеновской денситометрии (DEXA), закономерно считают одним из главных немодифицируемых факторов риска их развития и рассматривают как достоверный предиктор остеопоретических переломов [5].
Еще одним фактором риска ОП с высоким уровнем доказательности является недостаточное поступление кальция. Причем оно может быть связано как с неадекватным потреблением микроэлемента с пищевыми продуктами, так и с дефицитом витамина D, необходимого для обеспечения адекватной абсорбции кальция и регуляции обменных процессов в костной ткани. Дефицит витамина D является одним из доказанных модифицируемых факторов нарушений МПКТ и склонности к падениям, суммарно повышающих риск переломов [4]. Как известно, в условиях гиповитаминоза D даже достаточное поступление с пищей не может обеспечить нормального содержания кальция в крови.
Генетические заболевания, ассоциированные с дисплазией соединительной ткани, такие как синдром Марфана, Элерса-Данло, также относят к предикторам развития вторичного остеопороза [5]. Нарушения костного метаболизма представляют собой облигатные проявления различных наследственных соединительнотканных дисплазий [7], поскольку соединительная ткань, как и одна из ее разновидностей – ткань костная, состоят преимущественно из коллагеновых белков, синтез их контролируется теми же генами [1; 2]. Одним из наиболее часто встречающихся в клинической практике вариантов наследственных соединительнотканных нарушений является синдром гипермобильности суставов (СГМС) [6]. Лежащие в основе СГМС генетически детерминированные изменения в структуре коллагена могут обусловливать вовлечение в патологический процесс как хрящевых, так и костных структур.
Целью исследования явилась комплексная оценка количественных характеристик минеральной плотности костной ткани, маркеров костного метаболизма и ключевых регулирующих его гормонов у пациентов с синдромом гипермобильности суставов.
Материал и методы. Показатели минеральной плотности костной ткани, костного минерального обмена и уровни основных кальцийрегулирующих гормонов, маркеры остеорезорбции и костного формирования изучены у 122 пациентов (64 мужчин и 58 женщин) с СГМС в возрасте от 18 до 34 лет (средний возраст 23,07±2,4 года). Гипермобильный синдром диагностировали по шкале Р. Beighton согласно действующим критериям [6].
В исследование не включались больные с классифицируемыми моногенными наследственными заболеваниями (синдромами Элерса-Данло, Марфана, несовершенным остеогенезом и др.). Была проведена двухэнергетическая рентгеновская абсорбциометрия (DEXA) с определением МПКТ периферического отдела скелета – предплечья недоминирующей руки. Интерпретацию полученных данных осуществляли согласно критериям ВОЗ [5] с использованием Z-критерия. При этом за нормальные показатели МПКТ принималось значение Z-критерия от –1,0 до +2,5 SD, отклонение в интервале от –1,0 до –2,0 расценивалось как остеопения, а значения Z-критерия менее -2,0 SD соответствовали диагностическому показателю «костной массы ниже возрастной нормы». Изучали уровни кальция и фосфора в сыворотке крови. С помощью иммунохемилюминисцентного анализа определяли уровни паратиреоидного гормона (ПТГ), 25(ОН) витамина D (25(ОН)D3). Оценивали сывороточное содержание остеокальцина (ОК) и активность общей щелочной фосфатазы (ОЩФ) как маркеров костного формирования, уровень С-концевого телопептида коллагена I типа в качестве маркера остеорезорбции (Roche, Швейцария). В контрольную группу были включены 25 человек, сопоставимых по полу и возрасту (средний возраст 22,3±3,6 года), без внешних признаков дисплазии соединительной ткани, в том числе гипермобильного синдрома. Z-критерий в контрольной группе был не менее –1,3 SD.
Результаты статистически обработаны. Количественные данные представлены в виде средней и стандартной ошибки средней. Достоверность межгрупповых различий устанавливали с помощью критерия Ньюмена-Кейлса. Достоверность различий качественных признаков оценивали с помощью критерия χ2. Достоверными считали различия при p≤0,05.
Результаты и обсуждение. Выраженность гипермобильности в суставах по шкале Beighton чаще всего (45,9%) соответствовала 5 баллам. У 16,4% пациентов данный показатель составил 3 балла, у 25,4% – 4 балла. Крайние степени гипермобильности – 7 и 9 баллов – выявлены соответственно у 4,9 и 7,4% пациентов.
Остеоденситометрическое исследование выявило высокую распространенность остеопенического синдрома в группе пациентов с СГМС, превышающую показатели контрольной группы (рис. 1).
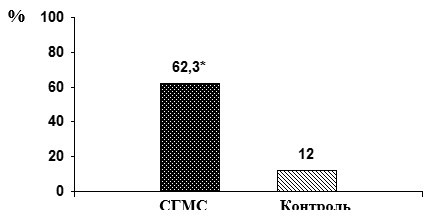
Рис. 1. Распространенность остеопении у пациентов с СГМС
Среди молодых мужчин с СГМС абнормальные значения Z-критерия выявлены у 48,4%, тогда как в группе женщин с СГМС аналогичного возраста низкая МПКТ обнаружена у 77,6% обследованных.
При детализации степени снижения минеральной костной плотности по отношению к пиковой костной массе у 23,7% пациентов с СГМС Z-критерий оказался менее –2,0 SD, т.е. соответствовал диагностическому понятию «костной массы ниже возрастной нормы». Такая частота низкой минеральной костной плотности практически сопоставима с распространенностью остеопороза в популяции менопаузальных женщин [5; 10]. У 6 пациентов с СГМС (4,9%) отмечено значительное снижение МПКТ: ≤–3 SD, причем в подавляющем большинстве случаев (5 из 6) в анамнезе имелись указания на переломы длинных трубчатых костей, что соответствует диагностическим критериям остеопороза. У четырех больных этой группы степень гипермобильности суставов составила 5 баллов, по одному случаю – 7 и 9 баллов. Наименьшее значение Z-критерия, равного –3,8 SD, отмечено у пациента с суставной гиперподвижностью в 7 баллов.
Снижение остеоденситометрических параметров для лиц молодого возраста не является физиологическим состоянием. Максимальные значения плотности костной ткани достигаются к 25-30 годам, а здоровая костная ткань в этом возрасте характеризуется строгой сбалансированностью процессов ремоделирования. Качественные и количественные характеристики кости, сформированные в этот период, во многом определяют дальнейший прогноз индивидуума в плане развития остеопоретических переломов в пожилом возрасте.
Несмотря на большую распространенность остеопении среди женщин с СГМС, в группе пациентов с МПКТ, соответствующей остеопорозу, преобладали мужчины (р>0,05) (рис. 2).
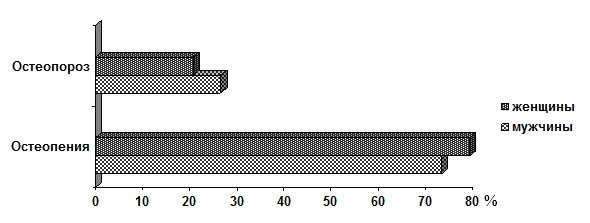
Рис. 2. Распределение пациентов с гипермобильностью суставов по степени снижения МПКТ
Следует отметить, что в структуре распределения денситометрических показателей половых различий не установлено: как у мужчин, так и у женщин более чем в 70% случаев Z-критерий был характерен для остеопении. Каждый четвертый мужчина и каждая пятая женщина по минеральной костной плотности попадали в референтный интервал костной массы ниже возрастной нормы. Вместе с тем в общей популяции женщины, как правило, имеют худшие показатели МПКТ, чем мужчины. Это связано с особенностями их гормонального статуса, меньшими размерами костей и меньшей общей костной массой, а также большими темпами её возраст-ассоциированных потерь [5]. Таким образом, наличие случаев выраженного снижения МПКТ среди молодых мужчин с СГМС придает проблеме особый интерес в связи с возможностью высокого кумулятивного риска остеопороза.
Выявленные в группе пациентов с СГМС особенности костного минерального обмена характеризовались незначительно сниженными или низконормальными показателями общего кальция крови на фоне сохраненного референсного значения фосфатемии. Гипокальциемию при этом имели 23,8% обследуемых с СГМС, тогда как в контрольной группе этот показатель был в 3 раза меньше. Случаи гипокальциемии в исследуемой группе в основном носили характер умеренно выраженных: 2,07±0,13 ммоль/л у больных и 2,2±0,1 ммоль/л в контроле (p≤0,05). Различия в уровнях фосфора в крови были минимальными, составив 1,48±0,12 ммоль/л в группе СГМС и 1,46±0,18 ммоль/л в контрольной.
Анализ маркеров остеорезорбции и костного формирования, в частности остеокальцина, С-концевого телопептида как неотъемлемых компонентов процесса ремоделирования, существенных отклонений от нормы в группе пациентов с СГМС не показал.
Определение ПТГ, наряду с активными метаболитами витамина D, осуществляющего интегральную модулирующую роль в гомеостазе кальция и цикле костного ремоделирования, продемонстрировало достоверное снижение его уровня у пациентов с СГМС (18,4±4,5 по сравнению с 37,3±9,4 в группе контроля; р<0,05), однако значений, выходящих за пределы референсных, в обеих группах обследованных зафиксировано не было.
Средние показатели сывороточного уровня 25(ОН)D3 у пациентов с СГМС также были снижены (42,6±6,8 при уровне 56,5±8,4 в контрольной группе; р>0,05) и соответствовали уровню «недостаточности» при референсном интервале 47,7-144,0 нмоль/л [8].
Особенностью профиля регуляторов минерального обмена у пациентов с СГМС явилась достоверно высокая распространенность гиповитаминоза D (р≤0,05) (рис. 3).
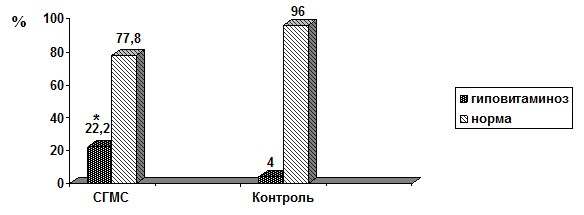
Рис. 3. Распространенность недостаточности 25 (ОН) D3 у пациентов с СГМС
Данные о высокой распространенности гиповитаминоза D в совокупности со снижением уровня ПТГ у пациентов с СГМС представляют особый интерес, учитывая характер взаимодействия системных регуляторов, их роль в обеспечении кальциевого гомеостаза и минерализации кости [9]. Помимо классического эффекта активной формы витамина D (D-гормона), направленного через взаимодействие с ПТГ на поддержание кальций-фосфорного гомеостаза, для него характерен ряд биологически важных плейотропных эффектов, реализующихся в мышечной и хрящевой ткани. Так, снижение плотности или аффинности рецепторов к D–гормону на скелетных миоцитах, как и снижение концентрации в крови самого 25(ОН)D3, может приводить к ослаблению мышечной силы [4]. Это ухудшает прогноз гипермобильности, поскольку именно гипотонус мышц, окружающих сустав, наряду с чрезмерной растяжимостью связок и снижением проприоцептивного суставно-мышечного чувства обусловливают возникновение подвывихов и вывихов у пациентов с СГМС. Нарушение метаболизма суставного хряща при дефиците витамина D сопровождается его ремоделированием и утолщением субхондральной кости [3], что снижает амортизационные способности суставных поверхностей и ускоряет дегенеративные изменения в хрящевых структурах.
Таким образом, пациенты с СГМС могут рассматриваться в качестве группы риска развития остеопенического синдрома. Для своевременного выявления недостаточности витамина D с адекватным его восполнением и коррекции дефицита кальция представляется целесообразным включение показателей костного метаболизма в алгоритм обследования пациентов с СГМС. Целенаправленное выявление низкой костной массы, создание оптимальных условий для её набора, достижения максимальных значений плотности, включая коррекцию модифицируемых факторов риска, должны стать важнейшей составляющей профилактических мероприятий у лиц с гипермобильным синдромом.
Рецензенты:
Гладких Н.Н., д.м.н., доцент кафедры госпитальной терапии Ставропольского государственного медицинского университета, г. Ставрополь;
Чагай Н.Б., д.м.н., доцент кафедры эндокринологии, детской эндокринологии и диабетологии Ставропольского государственного медицинского университета, г. Ставрополь.



