Решить проблему получения гаплоидных растений невозможно без глубокого изучения процесса морфогенеза гаплоидных клеток и тканей in vitro, влияющих на него факторов, в том числе генотипа донорных растений. Известно, что на процесс эмбриогенеза влияют генетические и физиологические факторы, стадии развития бутона, пыльника и микроспор, состав питательной среды и условия культивирования [4, 6, 8-10].
В селекции гетерозисных гибридов подсолнечника важное значение имеет использование маркерных генов. С этой целью применяют рецессивные гены, имеющие четкое фенотипическое проявление. Изучение эффектов таких генов проводят на основе почти изогенных или высоко беккроссных линий. Маркерные гены не должны существенно воздействовать на хозяйственно-ценные признаки, но могут оказывать плейотропные эффекты на другие признаки [1].
Целью данного исследования являлось изучение влияния маркерных генов и состава питательной среды на эффективность андрогенеза в культуре пыльников подсолнечника in vitro.
Материал и методы исследования
Объектами исследований служили самофертильная линия ЮВ-28Б и набор линий с генами l, la, o, pa, контролирующими нестандартную окраску язычковых цветков подсолнечника. Все линии созданы в генофоне линии ЮВ-28Б методом беккроссов.
Донорные растения исследуемых генотипов выращивали в полевых условиях. Корзинки срезали и стерилизовали в течение 15 минут 30 % хлорсодержащим препаратом «Белизна», затем промывали стерильной дистиллированной водой. С целью контроля соответствия морфологических критериев величины корзинки и размера цветков оптимальной стадии вакуолизированных одноядерных микроспор, проводили цитологический анализ под микроскопом на давленных препаратах, окрашенных ацетокармином по методике Паушевой З.П. [3].
В асептических условиях ламинар-бокса вычленяли неокрашенные пыльники и помещали на питательную среду. Использовали среду Мурасиге-Скуга с увеличенным содержанием нитрата калия КNO3 до 3,1 г/л, гидролизата казеина 400 мг/л и добавлением фитогормонов: β-индолил-3-уксусной кислоты (ИУК) 1 мг/л, 2,4-дихлорфеноксиуксусной кислоты (2,4 Д) 2 мг/л, 6-бензиноаминопурина (6 БАП) 0,5 мг/л. Для изучения влияния углеводов добавляли мальтозу или сахарозу в концентрации 30 г/л.
Опыт проводили в четырехкратной повторности по 100 пыльников каждая.
Анализ полученных на пыльниках новообразований проводили на 30 сутки культивирования. Полученные новообразования для регенерации переносили на питательную среду Мурасиге-Скуга с добавлением 6 БАП 0,5 мг/л, сахарозы 30 г/л, гидролизата казеина 500 мг/л, инозита 100 мг/л, глицин 2 мг/л и витамины: В1 – 10 мг/л, В2 – 5 мг/л, В6 – 10 мг/л, В12 – 0,015 мг/л, РР – 20 мг/л, С – 5 мг/л, фолиевая кислота – 5 мг/л, биотин – 2,5 мг/л. На следующем пассаже каллусы неоднородной структуры для инициации морфогенеза переносили на шесть вариантов сред, различающихся по составу гормонов: 1) 6 БАП 0,5 мг/л + НУК 0,1 мг/л; 2) 6 БАП 0,5 мг/л + НУК 0,1 мг/л + AgNO3 10 мг/л; 3) Кинетин 1мг/л + ИУК 0,1 мг/л; 4) Кинетин 1мг/л + ИУК 0,1 мг/л + AgNO3 10 мг/л; 5) 6 БАП 0,5 мг/л + ИУК 0,1 мг/л; 6) Кинетин 1мг/л + НУК 0,1 мг/л. Последующее пассирование каллусов и вновь образованных структур проводили на первоначальную среду для регенерации. В конце каждого пассажа подсчитывали количество каллусов с зонами морфогенеза, почками, листоподобными структурами и корнями.
Полученные данные обрабатывали методом двухфакторного дисперсионного анализа с использованием пакета программ Agros 2.10.
Результаты исследования и их обсуждение
На других культурах выделяют два основных пути морфогенеза [5]. Первый путь – это прямой эмбриогенез через образование соматических эмбриоидов. Второй путь – вторичный эмбриогенез и органогенез через формирование каллуса, а затем вторичную дифференциацию эмбриоидов и почек. В ходе цитологических исследований наблюдали, что большинство микроспор оставались без изменения, у них утолщалась клеточная стенка, цитоплазма сжималась и ядро занимало весь объем (рис. 1а). У части микроспор наблюдался процесс деления ядра, были обнаружены двуядерные (рис. 1б) и многоядерные микроспоры (рис. 1в), а также проэмбриональные комплексы (рис. 1г).
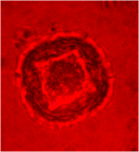
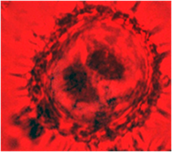
а б в г
Рис. 1. Анализ культуры пыльников подсолнечника на 30 сутки культивирования:
а- неразвивающиеся микроспоры, б- двуядерные микроспоры, в- многоядерные микроспоры, г- проэмбриональный комплекс
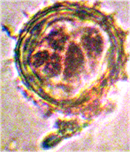
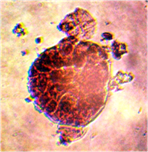
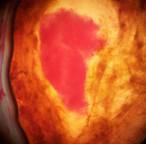
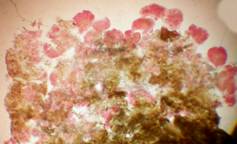
Наблюдалось формирование единичных и множественных эмбриоидов (рис. 2а, б) по форме схожих с эмбриоидами злаков [5], что соответствует прямому эмбриоидогенезу. Цитологический анализ каллусов показал, что в них формируются множественные эмбриоиды (рис. 2б). Это соответствует второму пути морфогенеза.
а б
Рис. 2. Формирование эмбриоидов: а- эмбриоид подсолнечника,
б- множественное образование эмбриоидов в клетках каллусов
На 30 сутки культивирования на пыльниках наблюдали большое количество каллусов двух типов – в основании пыльника на раневой поверхности соматический каллус и на боковой поверхности пыльника, предположительно андроклинного происхождения.
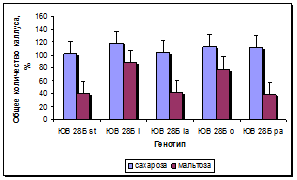
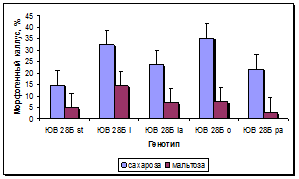
Эффективность каллусогенеза зависела от углеводного состава питательной среды и эффекта генотипа. Применение сахарозы в концентрации 30 г/л по сравнению с мальтозой в среднем за 3 года существенно повышало каллусогенез у изученных линий: у линии стандарта на 61%, у остальных линий от 31 до 62 %, в среднем почти на 42 %. Скрининг линий на среде с добавлением сахарозы 30 г/л показал, что все четыре линии достоверно превосходили линию стандарт по выходу каллуса от 7 до 21%, в среднем на 14%. На среде с добавлением мальтозы одна линия достоверно превосходила стандарт на 9,33 %, остальные линии находились на уровне стандарта (рис. 3а, б).
а б
Рис. 3. Влияние углеводного состава и эффекта генотипа на процесс каллусогенеза подсолнечника in vitro: а - общий выход каллуса, б - выход эмбриогенного каллуса
При последующем культивировании каллусов на среде для регенерации происходило оводнение каллусов, они активно разрастались, легко делились на части. После нескольких пассирований такие каллусы темнели и некротировали. Часть каллусов имели неоднородную структуру, в процессе пассирования они зеленели и приобретали механическую плотность. В последствии, на них формировались корни и почки с листоподобными структурами.
Способность каллусов к пассированию и морфогенезу зависела от генотипа донорных растений и состава питательной среды. Анализ результатов с помощью двухфакторного дисперсионного анализа и сравнения частных средних по тесту Дункана позволили оценить влияние каждого из этих факторов.
Состав среды оказывал достоверное влияние на процесс роста и морфогенеза в каллусах. Достоверно более высокая жизнеспособность каллусов наблюдалась на средах 2, 3, 4 и 6 (рис. 4а). Максимальный выход морфогенных каллусов наблюдался на питательной среде 4, содержащей Кинетин, ИУК и нитрат серебра. Наименьший уровень данного показателя наблюдался на средах 1 и 5, содержавших 0,5 мг/л БАП. На остальных средах отмечен средний уровень морфогенеза в каллусах (рис. 4б).
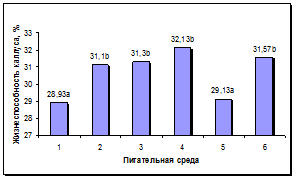
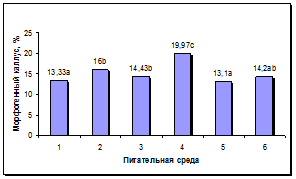
а б
Рис. 4. Влияние состава питательной среды для регенерации на процесс морфогенеза подсолнечника in vitro: а - жизнеспособность каллуса на разных питательных средах, б - выход морфогенного каллуса на разных питательных средах
Установлен существенный эффект генотипа донорных растений на сохранность каллусов в процессе пассирования и формирование в них морфогенных зон (рис. 5а, б). По сравнению с линией-стандартом у всех линий, несущих маркерные гены окраски язычковых цветков, выход каллусов был достоверно выше, при этом максимальная сохранность каллусов наблюдалась у линии с геном l, следующими по данному признаку в порядке убывания были линии с генами o, la и pa. По показателю выход морфогенных каллусов у линий с генами l и o установлено достоверное превосходство по сравнению с линией-стандартом и другими линиями. Линии с генами la и pa отличались средним уровнем выхода морфогенных каллусов: выше линии-стандарта, но ниже, чем у линий с генами l и o.
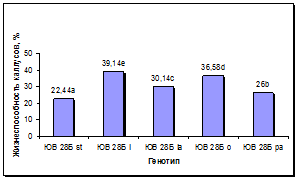
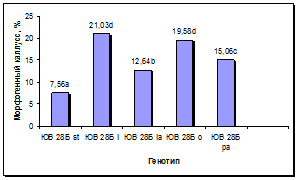
а б
Рис. 5. Влияние эффекта генотипа на процесс морфогенеза подсолнечника in vitro:
а - жизнеспособность каллуса разных генотипов, б - выход эмбриогенного каллуса разных генотипов
После пяти пассирований на каллусах формировались корни и почки. Линия-стандарт ЮВ-28Б и линия с геном ра формировали на каллусах только корни. У остальных линий наблюдалась регенерация почек. У линий с генами l до 90% каллусов формировали зеленые почки и корни в примерно равном соотношении. У линии с геном о около половины каллусов были способны к органогенезу. Образование альбиносных регенерантов, часто наблюдаемых в культуре пыльников in vitro, в данном исследовании не наблюдалось.
Заключение
В результате проведенных исследований установлено, что в процессе андрогенеза в культуре пыльников подсолнечника in vitro могут быть реализованы два пути морфогенеза: формирование эмбриодов и органогенез почек, листьев и корней.
Использование сахарозы по сравнению с мальтозой в среде для культивирования пыльников повышает эффективность каллусогенеза. Высокая способность к морфогенезу в каллусах всех изучаемых генотипов наблюдалась при добавлении 1 мг/л Кинетина, 0,1 мг/л ИУК и 10 мг/л AgNO3.
Введение в генофон линии ЮВ-28Б генов окраски язычковых цветков повышает способность клеток и тканей подсолнечника к каллусогенезу и морфогенезу в культуре in vitro. Наибольшее количество корней и листоподобных структур формировалось на каллусах линии с геном l.
Проведенные исследования позволяют расширить знания о регуляции процессов каллусогенеза и морфогенеза клеток и тканей подсолнечника in vitro. Определено влияние сахаров в составе питательной среды для каллусогенеза и фитогормонов в среде для регенерации. Выявлены маркерные гены окраски язычковых цветков, способные оказывать положительное влияние на морфогенез в культуре клеток и тканей in vitro подсолнечника, что позволяет предложить данный подход в качестве альтернативы традиционному способу оптимизации метода андрогенеза в культуре пыльников подсолнечника in vitro на основе подбора состава питательных сред. Полученные результаты позволят совершенствовать агробиотехнологии подсолнечника для нужд селекции.
Рецензенты:Дьячук Т.И., д.б.н., главный научный сотрудник лаборатории клеточной селекции ФГБНУ НИИСХ Юго-Востока, г. Саратов;
Антонюк Л.П., д.б.н., ведущий научный сотрудник лаборатории биохимии ФГБУН ИБФРМ РАН, г. Саратов.



