С точки зрения иммунологии беременность является уникальным состоянием, при котором в организме матери развивается наполовину чужеродный организм. Иммунная система матери проявляет толерантность к антигенным структурам плода, благодаря чему не происходит его отторжения [10]. Механизм этого процесса до сих пор остается неясным, однако продолжают появляться гипотезы, объясняющие этот феномен.
Онтогенез иммунной системы начинается в раннем эмбриональном периоде, продолжается в течение всей внутриутробной жизни и полностью завершается лишь через несколько лет после рождения. Известно, что во внутриутробном и неонатальном периодах плод, а впоследствии – новорожденный приобретает пассивный иммунитет от матери. Через плаценту к плоду поступают антитела, продуцируемые В-лимфоцитами матери. При нормально функционирующей плаценте в крови плода обнаруживаются только материнские иммуноглобулины G, однако при патологиях плаценты возможно попадание в кровь плода и других групп иммуноглобулинов. После рождения факторы иммунитета продолжают поступать в организм новорожденного вместе с материнским молоком. Известно, что в состав грудного молока входят иммуноглобулины, множество цито- и хемокинов, факторы врожденного иммунитета (комплемент, лизоцим, фактор хемотаксиса и др.), пребиотики, гормоны и даже некоторые виды клеток (макрофаги, нейтрофилы, лимфоциты) [9].
Состояние здоровья матери во время беременности также влияет на развитие иммунной системы плода. В современной литературе имеются данные о том, что поражение гепатобилиарной системы матери различной этиологии сопровождается угнетением Т-лимфоцитопоэза у потомства и приводит к нарушению клеточного иммунного ответа в раннем постнатальном периоде. Патология печени матери также ведет к изменению морфофункционального состояния клеток системы мононуклеарных фагоцитов потомства [7]. Длительная прегравидарная алкоголизация матери способствует развитию патоморфологических преобразований паренхимы тимуса новорожденных крыс [5]. Осложнения беременности (острый гестоз, угроза прерывания) являются факторами риска развития у детей тимомегалии [6].
Однако в известных нам источниках литературы мы не обнаружили информации о влиянии иммунодефицитных состояний во время беременности на формирование иммунной системы потомства. Широкая распространенность патологий иммунной системы в последние годы делает эту тему чрезвычайно актуальной. Известно, что у лиц с различными формами иммунодефицитов отмечается повышенная заболеваемость злокачественными новообразованиями [8]. Неуклонный рост онкопатологии, в т.ч. у детей, побуждает поднять вопрос о механизмах канцерогенеза на фоне иммунологической недостаточности.
Цель исследования – изучить влияние иммунодефицитного состояния во время беременности на формирование противоопухолевого иммунитета потомства.
Материал и методы исследования
Эксперименты выполнены на 150 белых нелинейных крысах-самцах в возрасте 3 месяцев. Животные были получены посредством спаривания 4-месячных крыс-самок с самцами массой 150-200 г. Спаривание спленэктомированных самок с самцами проводилось спустя месяц после спленэктомии. Кормление, уход и выведение из эксперимента крыс проводились согласно правилам обращения с лабораторными животными. В качестве модели вторичного иммунодефицита выбрана спленэктомия.
Животные были разделены на четыре группы: 1 – потомство здоровых самок – 30 крыс; 2 – потомство здоровых самок, которым через 1 месяц после рождения внутрибрюшинно вводили канцероген (1,2-диметилгидразин) из расчета 20 мг/кг 1 раз в неделю в течение 4 недель (общая доза составила 80 мг/кг) – 40 крыс; 3 – потомство спленэктомированных самок – 40 крыс; 4 – потомство спленэктомированных самок, которым через 1 месяц после рождения вводили канцероген по той же схеме – 40 крыс.
Объектом исследования служил тимус. При патоморфологическом исследовании учитывались частота развития новообразований, их морфологические особенности, локализация.
Для исследования срезов тимуса использовали следующие методы.
1. Окраска гематоксилином и эозином с последующей морфометрией коркового и мозгового вещества долек.
2. Морфометрический метод с использованием программы «Микро-Анализ» для измерения толщины коркового и площади мозгового вещества тимуса, оценки иммуногистохимических реакций.
3. Иммуногистохимические методы с использованием моноклональных (МКАТ) и поликлональных (ПКАТ) антител фирмы Santa Cruze (США) к крысиным антигенам:
а) ПКАТ к CD3 – для идентификации зрелых тимоцитов дольки;
б) МКАТ к CD68 – маркер макрофагов в структурах микроокружения долек тимуса;
в) МКАТ к белку S100 – маркеру антигенпрезентирующих дендритных клеток;
г) ПКАТ к синаптофизину – для идентификации клеток нейроэндокринного происхождения, к которым в тимусе относятся клетки APUD-серии;
д) МКАТ к панцитокератину – для неселективной идентификации эпителиальных клеток дольки.
4. Статистическая обработка полученных цифровых данных проведена с помощью пакета программ Microsoft office (Word и Excel). В работе приводятся следующие показатели: М — средняя арифметическая величина; m — средняя ошибка средней арифметической величины. Статистическую достоверность оценивали по t-критерию Стьюдента (t).
Результаты исследования и обсуждение
Масса тимуса потомства интактных крыс в возрасте 3-х месяцев составляет 304,2±24,0 мг. На окрашенных гематоксилином и эозином срезах хорошо определяются дольки округлой или полигональной формы со светлым мозговым и темным корковым веществом. Толщина коркового вещества равна 341,2±14,7 мкм, площадь мозгового вещества – 0,43±0,076 мм2.
При проведении иммуногистохимической реакции на CD3 для выявления зрелых Т-клеток обнаружено, что они расположены преимущественно в мозговом веществе долек и занимают 38,3±1,9% площади. В корковом веществе CD3+ клетки также встречаются, но занимают лишь 13,7±0,7% площади (рис. 1).
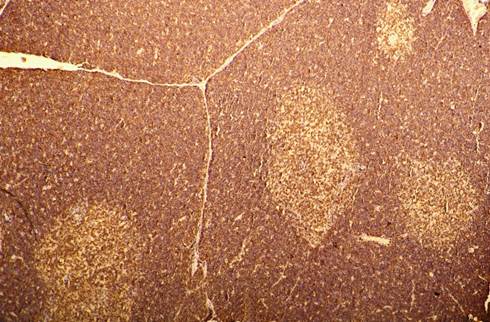
Рис. 1. Тимус потомства интактной крысы. Экспрессия CD3 в тимоцитах дольки. Иммуногистохимическая реакция с CD3, ув. 100x.
Установлено, что CD68+ клетки в тимусе потомства интактных крыс расположены в один ряд вокруг мозгового вещества, их количество составляет 17,5±1,4 клетки в поле зрения. Единичные макрофаги также встречаются и в корковом веществе долек. S100+ (дендритные) клетки главным образом встречаются в области кортико-медуллярной границы одиночно или группами по 2-3 клетки.
Положительная реакция на ПКАТ к синаптофизину обнаруживается у единичных клеток в корковом веществе. Панцитокератин-позитивные клетки (эпителиоциты) расположены равномерно по всей площади дольки и имеют сетевую организацию. В промежутках между эпителиальными клетками находятся тимоциты. Эпителиоциты мозгового вещества имеют более крупные размеры и занимают 31,6±1,1% площади. Эпителиальные клетки коркового вещества меньше мозговых и занимают 28,1±0,9% площади.
Нами выявлено, что беременность на фоне иммунодефицита и последующее введение канцерогена потомству приводит к выраженным морфологическим изменениям в тимусе уже через 30 суток после окончания курса инъекций, т.е. в возрасте 3-х месяцев. Установлено, что масса тимуса уменьшается во всех опытных группах по сравнению с контрольной и в группе потомства спленэктомированных крыс с введением канцерогена составляет 293,0±7,2 мг. Наиболее выраженные изменения массы наблюдаются в тимусе потомства спленэктомированных крыс без постнатального воздействия – показатель равен 236,2±30,9 мг (p<0,001).
Изменения наблюдаются и при морфометрии срезов, окрашенных гематоксилином и эозином. Так, в дольках тимуса потомства спленэктомированных самок площадь мозгового вещества уменьшается в 1,7 раза и равна 0,16±0,027 мм2. Толщина коркового вещества изменяется незначительно и составляет 300,7±14,2 мкм. В группе потомства спленэктомированных самок с введением канцерогена, напротив, большим изменениям подвержена толщина коркового вещества – она уменьшается в 2 раза по сравнению с контрольной группой и составляет 152,7±6,3 мкм. Площадь мозгового вещества уменьшается на 23% и равна 0,21±0,024 мм2 (p<0,01). Дольки деформированы, наблюдается смещение мозгового вещества на периферию, границы между дольками стерты.
Результаты подсчёта иммуногистохимических реакций в тимусе потомства спленэктомированных самок отличаются от аналогичных исследований контрольной группы. Особо значимо увеличивается численность макрофагов (в 1,5 раза) и клеток APUD-серии (более чем в 3 раза). Медуллярные эпителиоциты расходятся к периферии мозгового вещества, при этом в центральной области эпителиальные клетки отсутствуют (рис. 2).
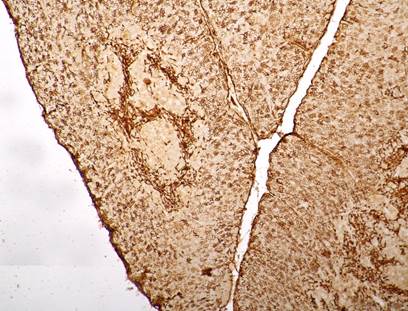
Рис. 2. Тимус потомства спленэктомированных самок. Смещение медуллярных эпителиоцитов к периферии мозгового вещества. Иммуногистохимическая реакция с Pan-cytokeratin, ув. 100х.
В тимусе потомства интактных крыс с последующим введением канцерогена наблюдается уменьшение количества CD3+ клеток как в корковом, так и в мозговом веществе, причем более значительное уменьшение (на 13%) в мозговом веществе (p<0,001). Количество S100+ и синаптофизин+ клеток, напротив, увеличивается. Клетки APUD-серии концентрируются на границе кортико-медуллярной зоны, а также встречаются в мозговом веществе (5-7 в поле зрения). Количество клеток, экспрессирующих CD68, а также корковых эпителиоцитов изменяется недостоверно, в то время как медуллярные эпителиальные клетки смещаются в область кортико-медуллярной границы.
В тимусе потомства спленэктомированных крыс с последующим введением канцерогена наблюдается еще более значительное уменьшение количества CD3+. В мозговом веществе они занимают лишь 20,2±2,1% площади (p<0,001). Количество макрофагов, напротив, увеличивается. Они располагаются в 2-3 ряда в премедуллярной зоне, а также в мозговом веществе долек. Количество синаптофизин+ и S100+ клеток также возрастает. Клетки, экспрессирующие панцитокератин, - эпителиоциты - в мозговом веществе располагаются плотной сетью на границе коркового и мозгового вещества, в центре мозгового вещества они отсутствуют, в то время как корковые эпителиоциты сохраняют сетевую организацию.
Заключение
Таким образом, нами выявлено, что удаление селезенки у самок влияет на морфофункциональное состояние тимуса их потомства. Это выражается в снижении его массы, уменьшении толщины коркового и площади мозгового вещества, увеличении количества макрофагов и клеток APUD-серии, изменении расположения медуллярных эпителиоцитов. Введение канцерогена потомству спленэктомированных самок вызывает более выраженные инволютивные изменения в тимусе по сравнению с введением канцерогена потомству интактных крыс: уменьшается количество CD3+ клеток с одновременным увеличением числа CD68+, S100+ и синаптофизин+ клеток, медуллярные эпителиальные клетки смещаются в премедуллярную зону.
Механизмы развития акцидентальной инволюции тимуса на фоне развития опухоли до сих пор остаются до конца не выясненными. Одни авторы считают пусковым фактором прямую индукцию апоптоза тимоцитов и уменьшение процента Т-клеток в S-стадии клеточного цикла. Другие считают наиболее значимым недостаточное поступление в тимус клеток-предшественников. Причём в костном мозге они сохраняются в достаточном количестве и являются функционально полноценными. Вероятно, это может быть следствием миграции клеток-предшественников из костного мозга в селезенку или опухоль [2]. Существует также мнение, что акцидентальная инволюция тимуса развивается как адаптивная реакция на стресс любой этиологии. Индукторами инволюции могут выступать глюкортикоидные гормоны, а также такие цитокины как TNF-α, IL-1, IL-4, TGF-β, VEGF [4].
Мы считаем, что инволютивные процессы в тимусе развиваются как вследствие токсического влияния самой опухоли [3], так и по причине дисфункции взаимодействия в системе «надпочечники-гипофиз-тимус» [1]. Посредниками взаимодействия эндокринной и иммунной систем в этом случае являются дендритные клетки, способные при их стимуляции секретировать те или иные иммунорегулирующие факторы.
Рецензенты:
Гунин А.Г., д.м.н., профессор, профессор кафедры акушерства и гинекологии ФГБОУ ВПО «Чувашский государственный университет им. И.Н. Ульянова», г. Чебоксары.
Смелов С.В., д.м.н., доцент кафедры нормальной и топографической анатомии с оперативной хирургией ФГБОУ ВПО «Чувашский государственный университет им. И.Н. Ульянова», г. Чебоксары.



