В последнее время в клинической цитогенетике всё более широкое применение получают молекулярно-цитогенетические технологии на базе сравнительной геномной гибридизации (CGH). Эти технологии позволяют обнаруживать субмикроскопические несбалансированные перестройки хромосом, не выявляемые стандартными методами цитогенетики (кариотипированием), поскольку разрешающая способность сравнительной геномной гибридизации превышает таковые в десятки и сотни раз [1-3; 8; 9].
Хромосомные аномалии – наиболее частая причина задержки психоречевого развития, умственной отсталости, аутизма, а также врождённых пороков и микроаномалий развития. Среди разнообразных структурных перестроек хромосом видное место занимают транслокации между хромосомами. Такие структурные перестройки могут быть сбалансированными и не вызывать какие-либо клинические проявления, но довольно часто транслокации ведут к потере хромосомного материала либо к его увеличению (микроаномалиям), вызывая, таким образом, различные нарушения развития, связанные как с деятельностью нервной системы (умственная отсталость, задержка психоречевого развития, аутизм), так и с другими системами организма ребёнка [1; 2; 5].
Результаты исследования и обсуждение
В нашем исследовании представлена девочка, 1 года, со следующими клиническими признаками: грубая задержка физического и психомоторного развития, макроцефалия, врождённый порок сердца, микроаномалии развития (открытый родничок, узкие глазные щели, низко посаженные диспластичные ушные раковины, запавшая переносица, выступающий лоб, короткая шея, небольшие кисти и стопы). Ребёнок был ранее кариотипирован по месту жительства: кариотип ребёнка – 46, ХХ. Несмотря на это, с учётом клинических признаков, было принято решение повторить цитогенетическое исследование, поскольку у ребёнка грубая задержка и микроаномалии развития были выражены очень резко и заставляли предположить наличие хромосомной аномалии. Культивирование лимфоцитов периферической крови, приготовление препаратов и окрашивание хромосом по длине, цитогенетический анализ проводились по стандартным протоколам [1; 2]. Кариотип ребёнка после стандартного цитогенетического исследования с использованием G- и С-методов дифференциального окрашивания хромосом представлен как 46,ХХ,t(6;8)(q22;q2?3.3),1qh-.
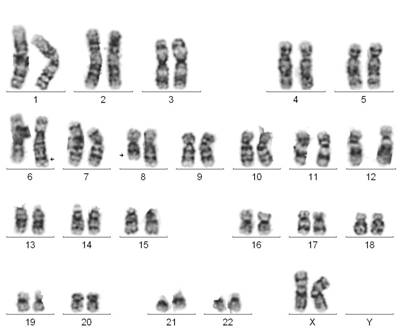
Рис. 1. Кариотип пациента после проведения GTG-окрашивания. Видна реципрокная транслокация между хромосомами 6 и 8. Кариотип - 46,ХХ,t(6;8)(q22;q2?3.3),1qh-
Для уточнения точек разрыва при транслокации было рекомендовано молекулярно-цитогенетическое исследование (молекулярное кариотипирование). Также было рекомендовано проведение цитогенетического исследования родителям ребёнка. Молекулярное кариотипирование данному пациенту проводилось по стандартным протоколам на микрочипах с использованием SNP/олигонуклетидной микроматрицы, содержащей примерно 2,7 миллиона проб и обладающей разрешением не менее 1000 пар нуклеотидов [6; 7]. В результате молекулярный кариотип ребёнка представлен как arr3q27.2(185,973,112-185,981,810)x1, 4q13.1(66,503,981-66,511,360)x1 (согласно ISCN 2013). Несбалансированные хромосомные и геномные перестройки (более 1 млн пн) у ребенка не выявлены. Были обнаружены интрагенные вариации числа копий последовательностей ДНК в виде делеций гена DGKG и гена EPHA5. Делеция последовательности ДНК гена DGKG [OMIM:601854], расположенного в участке 3q27.2 (геномная локализация: 185973112-185981810), составила 8698 пн (рис. 2) и затронула с пятнадцатого по семнадцатый экзоны. Повышенная экспрессия гена DGKG наблюдается в клетках мозжечка. Данная делеция ни разу не индексировалась в базах данных непатогенных геномных вариаций. Делеция последовательности ДНК гена EPHA5 [OMIM:60004] расположена в участке 4q13.1 (геномная локализация: 66503981-66511360), её размер составил 7379 пн (рис. 3). Делеция затронула второй экзон гена EPHA5, который участвует в одной геномной сети (геномная сеть аксонального наведения [KEGG ID: hsa04360 (axon guidance)]). Повышенная экспрессия данного гена наблюдается в клетках эмбрионального мозга.
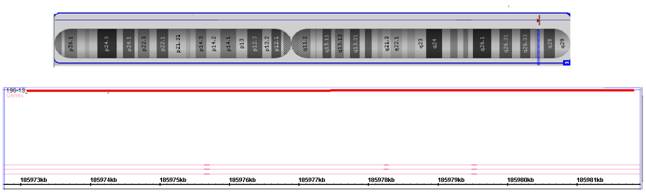
Рис. 2. Микроделеция хромосомы 3 в участке 3q27.2 размером 8698 пар нуклеотидов
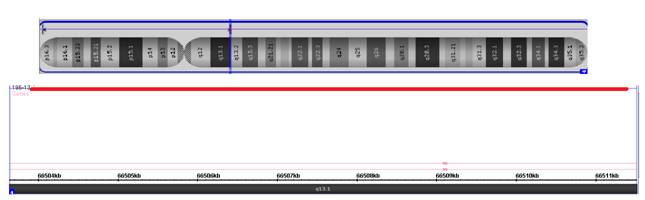
Рис. 3. Микроделеция хромосомы 4 в участке 4q13.1 размером 7379 пар нуклеотидов
Результаты молекулярного кариотипирования позволяют предположить, что обнаруженные интрагенные вариации числа копий последовательностей ДНК данных генов могут быть ответственны за клинические симптомы, обнаруженные у ребёнка [4-7]. Данное исследование не обнаружило микроделеции или микродупликации хромосом в точках разрыва при транслокации, что позволяет считать данную транслокацию сбалансированной. Возможно, точки разрыва при данной транслокации могут находиться в экзонах генов данных участков хромосом или же между ними, что может функционально соответствовать генным мутациям или изменять экспрессию генов в точках разрыва и тем самым вызывать патологические проявления в организме [1; 2; 5].
Заключение
Данный случай со всей очевидностью указывает на необходимость проведения детям с выраженной задержкой развития стандартного цитогенетического исследования с дифференциальным окрашиванием хромосом по длине (применение метода G-окрашивания хромосом с разрешением не менее 500-600 полос на гаплоидный хромосомный набор и обязательным дополнительным использованием метода С-окрашивания) [1-3; 9]. Более того, при молекулярной диагностике геномной или хромосомной патологии необходимо использование высокотехнологических молекулярно-цитогенетических методов для обнаружения структурных перестроек (даже в случаях сбалансированных хромосомных аномалий) [4-9]. Подобные исследования позволят установить корреляцию «генотип-фенотип» и, возможно, выявить гены-кандидаты различных аномалий развития, а также проводить более эффективное медико-генетическое консультирование семей, в которых есть дети с умственной отсталостью и врождёнными пороками развития.
Исследование выполнено за счет гранта Российского научного фонда (проект № 14-15-00411).



