Острая тонкокишечная механической непроходимость (ОТМН) — одна из наиболее актуальных проблем среди экстренных хирургических заболеваний. Многообразие этиологических факторов, сложность патогенеза, трудности диагностики отражаются на результатах лечения [1, 3, 6, 7, 8]. Послеоперационная летальность при ОТМН составляет от 6,5 до 9,4%, что определяет научно-практическую значимость изучаемой проблемы [8, 9]. В результате анализа неблагоприятных исходов при хирургическом лечении больных с ОТМН сделаны выводы, что у наибольшего количества умерших в ранние сроки после операции имелись глубокие нарушения обмена, одной из причин которых является синдром энтеральной недостаточности [4, 8].
У больных в послеоперационном периоде происходит мощный выброс стрессовых гормонов – катехоламинов, глюкагона, обладающих выраженным катаболическим действием. Энергетические затраты увеличиваются до 50–150%, что определяет необходимость ранней энтеральной нутритивной поддержки в послеоперационном периоде [10].
Функциональные и морфологические изменения в стенке тонкой кишки на различных этапах развития ОТМН определяют важнейшие осложнения этого тяжелого заболевания и смертельные исходы [4]. Проведено много экспериментальных работ на животных, свидетельствующих о важности микроциркуляции в стенке тонкой кишки для улучшения результатов лечения ОТМН [6]. Многие авторы считают, что микроциркуляторные нарушения наступают раньше клинических и исчезают позже последних [4, 6, 8]. Для улучшения результатов лечения ОТМН существенное значение имеют проведение патогенетической терапии и скорейшее восстановление функции тонкой кишки.
Цель исследования – разработать и патогенетически обосновать оптимальную тактику послеоперационного лечения больных с ОТМН.
Материалы и методы. Клиническое исследование выполнено на 68 (100%) больных с ОТМН, осложненной некрозом кишки, на базе ГКБ № 67 им. Л.А. Ворохобова ДЗ г. Москвы в период 2009–2014 гг. Были обследованы 34 (50%) женщины и 34 (50%) мужчины. Всем больным была выполнена резекция нежизнеспособного участка тонкой кишки. Объем резекции кишки зависел от степени ОТМН на основании ранее проведенных исследований [2], при которых было установлено, что для компенсированной ОТМН оптимальным объемом резекции является 10 см в проксимальном направлении от макроскопических границ некроза и 5 см — в дистальном направлении, при субкомпенсированной ОТМН — 15 см в проксимальном направлении от макроскопических границ некроза и 10 см в дистальном. В условиях декомпенсированной ОТМН объем резекции следует увеличивать до 30 см в проксимальном направлении от макроскопических границ некроза и 15 см — в дистальном. Время с момента начала заболевания до поступления в стационар составило 4,98±3,63 ч. Наиболее частой причиной ОТМН были спайки брюшной полости – 42 (61,8%), на втором месте — ущемление грыж – 24 (35,3%), реже заворот тонкой кишки – 2 (2,9%) пациента. Сопутствующие хронические заболевания были выявлены у 46 (67,6%) пациентов (сердечно-сосудистые заболевания, болезни легких, сахарный диабет 2-го типа, хронический пиелонефрит, мочекаменная болезнь, полинейропатия).
Выделяли 3 степени компенсации кишечной непроходимости (КН): компенсированная, субкомпенсированная, декомпенсированная [5]. Степень КН определяли на основании клинической картины, обзорной рентгенографии брюшной полости в положении стоя, ультразвукового исследования (УЗИ) брюшной полости. Компенсированной считали такую КН, при которой на обзорной рентгенограмме брюшной полости выявляли пневматизацию с единичными уровнями жидкости в тонкой кишке; при УЗИ брюшной полости обнаруживали дилятацию тонкой кишки, в просвете — газ и незначительное количество жидкости, при этом толщина стенки не превышала 4 мм, а моторно-эвакуаторная функция была снижена, но сохранена. К субкомпенсированной относили КН, при которой обнаруживали множественные уровни жидкости с газом в тонкой кишке и складками Керкринга, что отражает отек стенки кишки. Данные рентгеносемиотики подтверждали УЗИ брюшной полости, при котором выявляли не только расширение просвета с жидкостным содержимым, но и отек стенки тонкой кишки (толщина стенки до 7 мм) с двойным контуром и сохраненной моторной функцией кишки в виде маятникообразных движений. Критериями декомпенсированной КН являлись множественные тонкокишечные уровни с локализацией арок во всех отделах брюшной полости; при УЗИ — резкая дилятация тонкой кишки, жидкость и газ во всех проксимальных отделах тонкой кишки, толщина ее стенки >7 мм, моторно-эвакуаторная функция отсутствует.
Операцию выполняли в первый час от поступления после предварительной подготовки – коррекции гемодинамических и водно-электролитных нарушений. Всем пациентам выполнены лапаротомия, интраоперационная декомпрессия кишечника при субкомпенсированной и декомпенсированной ОТМН с помощью зонда Эббота—Мюллера, резекция нежизнеспособного участка тонкой кишки с формированием анастомоза бок в бок двухрядным швом, санация и дренирование брюшной полости.
Для сравнения методов разрешения динамической кишечной непроходимости (ДКН) выделили две группы: основную (I) – 40 (58,8%) больных и контрольную (II) – 28 (41,2%) больных. В I группе после декомпрессии тонкой кишки и устранения ОТСН устанавливали интраоперационно-назоинтестинальный зонд (НИЗ) в тощую кишку для разрешения ДКН и проведения раннего энтерального зондового питания (ЭЗП) в послеоперационном периоде. В 1-е сутки после операции в НИЗ со скоростью 100–150 мл/мин вводили охлажденный до 14–16оС 0,9%-ный раствор NaCl в объеме 1200–1500 мл, что способствовало разрешению ДКН. Критериями разрешения ДКН и восстановления функции кишечника являлись: сокращение объема отделяемого по назогастральному зонду, положительная проба на капельное введение 300 мл подогретого до 35–37⁰С физиологического раствора в тощую кишку под контролем УЗИ, жидкий стул. После устранения ДКН проводили раннее ЭЗП сбалансированными энтеральными смесями с последующим переводом на сипинг и оральное питание.
Во II группе для коррекции водно-электролитных нарушений и белково-энергетической недостаточности до разрешения ДКН проводили полное парентеральное питание, в дальнейшем разрешали пить и переводили на оральное питание.
Статистический анализ полученных результатов проводили с применением статистического пакета StatisticaforWindows v. 7.0, StatSoftInc. При сравнении групп по качественным признакам применяли односторонний точный критерий Фишера. При сравнении по количественным признакам независимых групп применяли критерий Манна—Уитни, по количественным признакам зависимых групп – критерий Вилкоксона. Статистически значимыми считались различия при р<0,05.
Результаты исследования. Выявили, что в I группе было 18 (45%) пациентов с компенсированной, 16 (40%) — с субкомпенсированной и 6 (15%) — с декомпенсированной ОТМН, во II группе было 12 (42,9%) пациентов с компенсированной, 11 (39,2%) — с субкомпенсированной и 5 (17,9%) — с декомпенсированной ОТМН. Провели сравнительный анализ результатов лечения двух групп. При анализе трофического статуса (ТС) на протяжении всего послеоперационного периода выявлено, что к 10-м суткам после операции в I группе отмечается тенденция к повышению сывороточного альбумина, трансферрина и лимфоцитов. Во II группе увеличения этих показателей отмечено не было. В результате проведенного анализа изменений ТС у пациентов с ОТМН видно, что использование раннего отмывания тонкой кишки и коррекция белково-энергетической недостаточности ЭЗП позволяет поддержать и стабилизировать ТС в раннем послеоперационном периоде и препятствовать развитию системной воспалительной реакции (рис. 1–5).
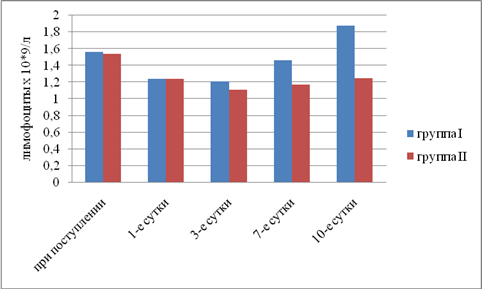
Рис. 1. Динамика изменений абсолютного числа лимфоцитов (р<0,05)
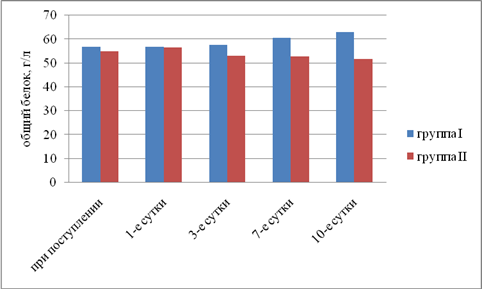
Рис. 2. Динамика изменений общего белка плазмы (р<0,05)
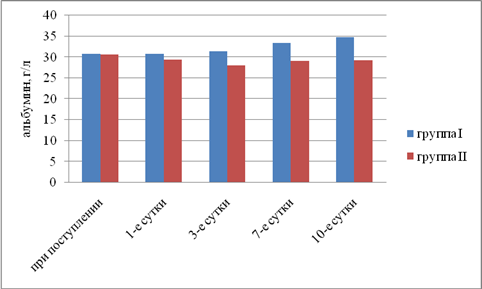
Рис. 3. Динамика изменений сывороточного альбумина (р<0,05)
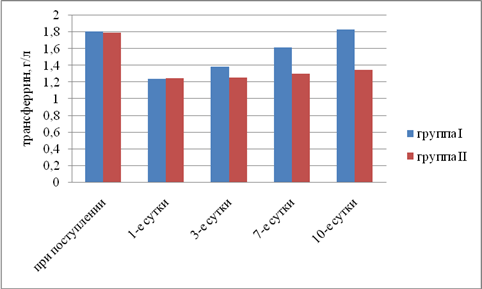
Рис. 4. Динамика изменений трансферрина (р<0,05)
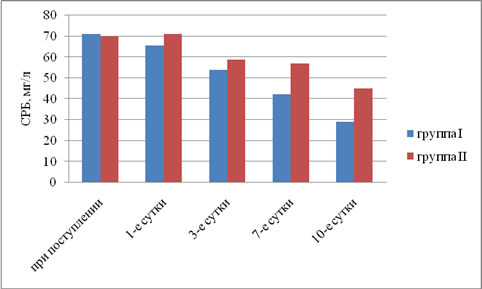
Рис. 5. Динамика изменений С-реактивного белка (р<0,05)
При сравнительном анализе результатов лечения обеих подгрупп выявлено, что во II группе, где отмывание тонкой кишки и раннее ЭЗП не применяли, выше уровень послеоперационных осложнений, больше сроки разрешения ДКН, выше уровень летальности и больше сроки госпитализации (табл. 1).
Таблица 1
Данные о результатах лечения в I и II группах
|
Показатель |
группа I |
группа II |
Достоверность |
|
Послеоперационные осложнения |
2 (5,00%) |
9 (32,14%) |
р=0,004* |
|
Сроки разрешения ДКН, ч |
30±9,8 |
46,3±13,85 |
p<0,001** |
|
Сроки госпитализации, сутки |
11,2±1,73 |
14,63±2,24 |
р=0,004** |
|
Летальность |
0 (0%) |
2 (7,14%) |
р=0,166* |
Прим.: * Односторонний критерий Фишера; ** Критерий Манна—Уитни
Большую часть осложнений у пациентов II группы составляли гнойно-септические осложнения, что объясняли отсутствием адекватной коррекции белково-энергетической недостаточности в раннем послеоперационном периоде на фоне сопутствующих заболеваний. Выраженные метаболические нарушения, пожилой и старческий возраст, тяжелая хирургическая травма с выраженной катаболической реакцией, длительные сроки госпитализации явились основными причинами развития осложнений.
Заключение. Наиболее оптимальным методом разрешения ДКН в раннем послеоперационном периоде является интраоперационная декомпрессия тонкой кишки с аспирацией кишечного содержимого с последующей установкой назоинтестинального зонда для раннего отмывания тонкой кишки охлажденным до 14–16оС 0,9%-ным раствором NaCl. Отмывание тонкой кишки позволяет сократить объемы инфузионной терапии.
В условиях послеоперационной травмы организма именно кишечник становится основным источником инфекции и источником неконтролируемой транслокации микробов и их токсинов в кровь, что лежит в основе формирующейся системной воспалительной реакции и развивающейся на этом фоне полиорганной недостаточности. В связи с этим назначение больным с ОТМН ЭЗП позволяет минимизировать последствия агрессивного воздействия различных факторов на желудочно-кишечный тракт и сохранять его структурную целостность и полифункциональную активность, что является необходимым условием для более быстрого выздоровления пациента.
Раннее энтеральное питание позволяет предотвратить прогрессирование белково-энергетической недостаточности, снижает частоту послеоперационных осложнений, летальность и длительность пребывания пациентов в стационаре.
Рецензент:
Алекперов С.Ф., д.м.н., заведующий 2-м хирургическим отделением ГКБ № 67 им. Л.А. Ворохобова ДЗ, г. Москва;
Черепанин А.И., д.м.н., заместитель главного врача по хирургии Клинической больницы № 1 МЕДСИ в Отрадном, профессор кафедры госпитальной хирургии № 1 лечебного факультета Первого МГМУ им. И.М. Сеченова, г. Москва.



