Традиционными объектами изучения процессов липопероксидации при различных формах нарушения кровообращения были и остаются сердце и головной мозг. Вместе с тем имеются органы и ткани, в частности почки, которые не менее уязвимы для повреждающих факторов ишемии и реперфузии [10, 12], а нарушение их функций лежит в основе вторичных нарушений кровообращения, водно-солевого обмена и интоксикации организма после перенесенного терминального состояния [8, 11]. Диапазон генетически детерминированных физиолого-биохимических реакций организма на экстремальные воздействия весьма широк, различия выявляются на системном, тканевом, клеточном и субклеточном уровнях и, безусловно, могут определять выживаемость животных после перенесенного критического состояния и восстановление функций [4, 5]. Хорошо известно, что соотношение «перекисное окисление липидов/антиоксидантные системы в мозге [6], сердце, печени [3]» влияет на чувствительность животных к гипоксии. Однако механизмы, определяющие особенности липопероксидации и устойчивости к ишемическим повреждениям почек, вызванным остановкой системного кровообращения, требуют дальнейшего изучения.
Цель работы – выявление особенностей процессов перекисного окисления липидов в почках у крыс с различной резистентностью к гипоксии в длительной динамике после ишемического повреждения, вызванного остановкой системного кровообращения, и их взаимосвязи со структурными повреждениями.
Материалы и методы. Серия экспериментов выполнена на 320 половозрелых самцах неинбредных белых крыс массой 150–180 г, содержавшихся в виварии на стандартном рационе и свободном доступе к воде, после предварительного тестирования на резистентность к гипоксии [1]. По итогам тестирования все животные были разделены на 4 группы – неустойчивые (НеУ), низкоустойчивые (НизУ), среднеустойчивые (СУ) и высокоустойчивые к гипоксии (ВУ). Группы включали по 70 опытных и 10 контрольных крыс. Через неделю после тестирования под общим эфирным наркозом моделировали 5-минутную аноксию интраторакальным пережатием сосудистого пучка сердца по методу Корпачева В.Г. (1982). Реанимация проводилась с помощью наружного массажа сердца и искусственной вентиляции легких. Контрольная группа крыс после тестирования на устойчивость к гипоксии подвергалась эфирному наркозу без моделирования аноксии. Период наблюдения составлял 35 дней. В гомогенатах тканей почек определяли содержание глутатиона восстановленного G-SH (Patterson et al., в модификации Путилиной Ф.Е., 1982), каталазы (Королюк М.А., 1988), ТБК-реагирующих продуктов (ТБК-рп) [7]. Морфологию почек изучали методом световой микроскопии окраской гематоксилином и эозином в динамике постреанимационного периода на 1-е, 3-и, 5-, 7-, 14-, 21- и 35-е сутки. Результаты статистически обрабатывали параметрическими методами с вычислением средних значений (m), стандартных отклонений (n). Достоверность различий средних оценивали по t-критерию Стьюдента, отношения между независимыми и зависимыми переменными исследовали с помощью дисперсионного анализа.
Результаты и обсуждение
До моделирования аноксии крысы с разной устойчивостью к гипоксии достоверно отличались по уровню функционирования защитных систем в клетках тканей почек. Так, активность каталазы и содержание восстановленного глутатиона были выше у ВУ животных в сравнении со СУ соответственно на 11% (р<0,05) и 13% (р<0,05); с НизУ – на 15% (р<0,01) и 20,4% (р<0,01); с НеУ – на 21% (р<0,001) и 28,6% (р<0,001). При этом активность процессов ПОЛ по уровню накопления ТБК-рп во всех группах животных не различалась.
Обработка полученных данных с помощью дисперсионного анализа выявила статистически значимое влияние (p<0,01) устойчивости к гипоксии на уровень ТБК-активных продуктов на 1-е, 5-е и 21-е сутки (рис. 1). На 1-е и 21-е сутки устойчивость к гипоксии уменьшала содержание ТБК-рп, т.е. у устойчивых к гипоксии животных их уровень был ниже, чем у неустойчивых, что свидетельствует о более эффективной работе антиоксидантных систем. Тем не менее на 5-е сутки в группе ВУ наблюдалось снижение адаптационных процессов, поскольку уровень ТБК-рп у них был выше, чем у НеУ и НизУ животных.
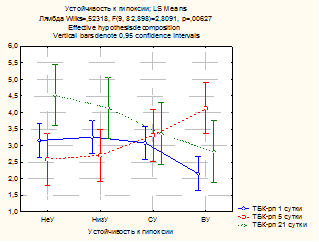
Рис. 1. Влияние устойчивости к гипоксии на уровень ТБК-рп в гомогенате почек
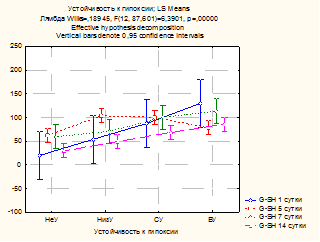
Рис. 2. Влияние устойчивости к гипоксии на содержание восстановленного глутатиона в гомогенате почек
На рисунке 2 хорошо видно, что уровень глутатиона повышается по мере возрастания показателя устойчивости к гипоксии (p<0,001), и самый низкий его уровень соответствует группе НеУ. Однако на 5-е сутки у животных, высокоустойчивых к гипоксии, очевидно, эффективность адаптационно-компенсаторных механизмов, оцениваемых по данному показателю, значительно снижается. Истощение ферментативного и неферментативного звеньев антиоксидантной защиты, возможно, связано с более высокой активностью в этой группе (ВУ) процессов липопероксидации.
Влияние устойчивости к гипоксии на уровень каталазы демонстрирует рисунок 3. Различия между средними значениями показателя в разных группах достоверны во все сроки наблюдения: чем больше резистентность животных к гипоксии, тем выше у них уровень каталазы. Хотя каталаза является ферментом, достаточно устойчивым к нарушениям свободно-радикального гомеостаза [2], тяжелое гипоксическое воздействие на животных с исходно низким уровнем каталазы (НУ и НизУ) вызывает критическое снижение ее активности в тканях почек. На 5-е сутки на фоне снижения каталазы адаптационно-приспособительная реакция у этих крыс осуществляется за счет напряжения неферментативного глутатионового звена. Восстановление активности каталазы в тканях почек до контроля происходило только к 35-м суткам.
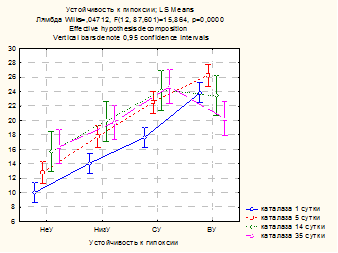
Рис. 3. Влияние устойчивости к гипоксии на активность каталазы в гомогенате почек
Анализ структурных изменений, происходящих в тканях почек, показал следующую динамику. На 1–3-и сутки постреанимационного периода у крыс ВУ в тканях коркового и мозгового вещества почек наблюдалось неравномерное кровенаполнение: на фоне выраженного полнокровия сосудов стромы со значительным числом кровоизлияний (рис. 4) отмечалось малокровие клубочков, которые выглядели спавшимися, а просветы клубочка были значительно расширены. Подобная картина могла свидетельствовать о шунтировании кровотока в обход клубочков, что существенно ухудшало процессы клубочковой фильтрации [9]. На этом фоне эпителий канальцев находился в состоянии зернистой и гиалиново-капельной дистрофии, что косвенно указывает на расстройства фильтрационной функции почек и наличие в первичной моче белка, который по механизму инфильтрации мог проникать в нефротелий. В гистологических препаратах НизУ и НУ крыс на 1–3-и сутки после оживления отмечалось малокровие почек: сосудистые клубочки спавшиеся, их размеры уменьшены (рис. 5). Капсулы клубочков и канальцы нефронов несколько расширены, однако клеточность не нарушена.
На 5–7-е сутки в группе ВУ и СУ к умеренному полнокровию сосудов стромы присоединялись органические изменения сосудистых стенок в виде их утолщения за счет эпизодов плазморрагии, плазматического пропитывания и продуктивной тканевой реакции, что укладывалось в картину эндомикроваскулита. В сосудистых клубочках кровенаполнение восстанавливалось, размеры их не отличались от исходных параметров. В то же время эпителий канальцев представлялся набухшим, с признаками зернистой дистрофии. Эти изменения происходили параллельно с усилением процессов липопероксидации, что проявлялось повышенным накоплением ТБК-РП и снижением глутатиона у ВУ животных, что было расценено нами как срыв адаптационно-компенсаторных механизмов.
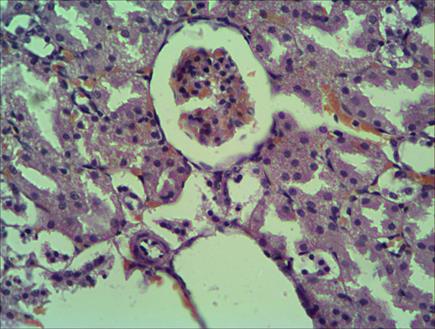
Рис. 4. Полнокровие сосудов мозгового вещества почек со значительным числом мелких кровоизлияний через сутки после оживления. Группа крыс, высокоустойчивых к гипоксии. Окраска гематоксилином и эозином. Микрофотография. Увел. Х100
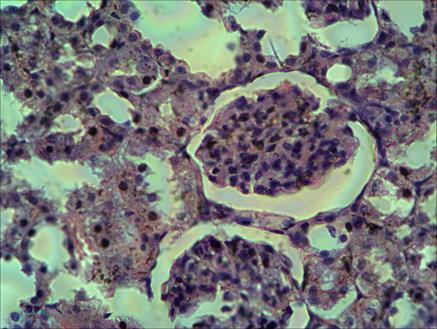
Рис. 5. Малокровные спавшиеся сосудистые клубочки на 1-е сутки после опыта. Группа крыс, неустойчивых к гипоксии. Окраска гематоксилином и эозином. Микрофотография. Увел. Х400
В препаратах почек НизУ и НУ крыс на 5–7-е сутки постреанимационного периода сохранялось низкое кровенаполнение как в клубочках, так и в сосудах стромы. Четко прослеживались значительные дистрофические изменения канальцев нефрона по типу зернистой дистрофии, набухания клеток. В просвете части канальцев наблюдались зернистые эозинофильные массы белкового происхождения (НУ). Кроме этого, в межуточной ткани отмечались множественные лейкоцитарные инфильтраты, что свидетельствует о нарастании интерстициального нефрита. Картина интерстициального нефрита сохранялась вплоть до 14 суток (НУ и НизУ).
К 10–14-м суткам постреанимационного периода у ВУ и СУ крыс в морфологической картине отмечалась положительная динамика. В клубочках кровенаполнение было близко к нормальному, капсула клубочка не изменена (ВУ), в строме оставались небольшие признаки слабости и неравномерности кровенаполнения (СУ). Основные же расстройства обнаруживались в канальцах нефрона, где имелись признаки зернистой дистрофии, особенно выраженные в проксимальном отделе. Просвет канальцев выглядел неровным из-за неравномерного набухания клеток, которые выглядели неравномерно прокрашенными. В просвете канальцев прослеживались розовые массы с единичными слущенными клетками и зернистыми эозинофильными массами, что свидетельствовало о формировании цилиндров.
На 21-е сутки постреанимационного периода морфологическая картина почек вновь резко ухудшилась, особенно в группе ВУ и СУ. На фоне неравномерного кровенаполнения сосудов стромы появлялись многочисленные участки с кровоизлияниями, как и в ранние сроки после оживления, хотя в меньшем количестве и менее выраженные. Со стороны клубочкового аппарата отмечалось утолщение стенок парагломерулярных артериол вследствие отека и продуктивной реакции по типу эндоваскулита. В канальцах продолжали отмечаться изменения по типу зернистой дистрофии, клетки канальцев оставались увеличенными, набухшими, что приводило к сужению просвета канальцев.
К концу периода наблюдения морфологическая картина несколько улучшалась, нормализовалось кровенаполнение сосудистых клубочков. В то же время уровень кровенаполнения стромальных областей оставался пониженным, а со стороны канальцев нефрона по-прежнему выявлялась зернистая дистрофия. Эпителий канальцев нефрона оставался таким же набухшим, а в их просветах выявлялись зернистые цилиндры со слущенными клетками эпителия. Таким образом, полной нормализации гистоструктуры почек не произошло в этих группах животных и на 35-е сутки постреанимационного периода.
В препаратах почек НизУ и НУ к концу 21-х суток впервые появляется некоторая положительная морфологическая динамика. Кровенаполнение сосудов остается еще слабым, однако кровь в них обнаруживается. Наряду с нормальными почечными тельцами встречаются спавшиеся, подтянутые клубочки, с расширенными капсулами. Со стороны единичных почечных телец можно отметить явления очагового гломерулосклероза. Эпителий канальцев дистрофирован, размеры клеток в пределах нормы. В ряде препаратов отмечается выраженное полнокровие сосудов стромы мозгового вещества с кровоизлияниями и участками геморрагического пропитывания. К концу периода наблюдения (35-е сутки) в большинстве препаратов значимых патологических изменений не обнаруживается. Степень кровенаполнения сосудов нормализовалась. Сами сосуды внешне без изменений, однако в некоторых участках почек обнаруживаются сосуды с явлениями гиалиноза стенок артериол. В целом паренхима почек имеет нормальный вид. Просвет канальцев свободен. Сохраняются слабовыраженные дистрофические изменения канальцев, эпителий уплощен.
Таким образом, в ранние сроки после оживления (1–3-и сутки) у животных превалировали нарушения микроциркуляции, зависящие от уровня устойчивости к гипоксии и приводящие к дистрофическим изменениям как клубочков, так и канальцев. В последующем кровенаполнение клубочков в той или иной степени улучшалось, а основные расстройства обнаруживались в канальцах нефронов (10–14-е сутки). Следует подчеркнуть, что улучшение морфологической картины у животных НУ и НизУ происходило постепенно, без сколько-либо значимых качественных скачков, в то время как у ВУ периоды восстановления (14-е сутки) сменялись периодами значительного ухудшения (21-е сутки). Полного восстановления структуры почечной ткани так и не произошло ни в одной из групп животных.
Заключение
Результаты исследований свидетельствуют, что развитие и исход ишемического повреждения почек, вызванного остановкой системного кровообращения, обусловлены индивидуальными физиолого-биохимическими характеристиками животных, которые, очевидно, во многом генетически детерминированы. У крыс, высокоустойчивых и среднеустойчивых к гипоксии, отмечались исходно высокие показатели антиоксидантной защиты, которые тем не менее оказывались недостаточно эффективными в ранние сроки после реанимации (3–-е сутки). У животных, неустойчивых к гипоксии, на фоне недостаточности антиоксидантной защиты наблюдалась высокая активность процессов липопероксидации, которая продолжала нарастать, достигая максимальных значений на 21–35-е сутки. Данные процессы взаимообусловлены, поддерживают друг друга, приводя к стойким нарушениям в работе паренхиматозных органов, что к концу периода наблюдения в почках проявляется развитием необратимых повреждений в виде гломерулосклероза и гиалиноза клубочкового аппарата. Поэтому повышение антиоксидантной защиты почек в постреанимационном периоде рассматривается нами как необходимое условие сохранения их структурно-функциональной целостности и активности.
Рецензенты:
Каюмова А.Ф., д.м.н., профессор, зав. кафедрой нормальной физиологии ГБОУ ВПО «Башкирский государственный медицинский университет» МЗ РФ, г. Уфа;
Хисматуллина З.Р., д.б.н., доцент, зав. кафедрой физиологии человека и зоологии ФГБОУ ВПО «Башкирский государственный университет» МО РФ, г. Уфа.



