Особенностью медико-генетического консультирования является его профилактическая направленность. Значительный прогресс в профилактике врожденной и наследственной патологии связан с разработкой и внедрением в практику комплекса методов пренатальной диагностики, позволяющих дать оценку состояния плода, установить точный диагноз для предоставления будущим родителям исчерпывающей информации о степени риска рождения больного ребенка. В зависимости от задач исследования и сроков беременности используются различные генетические методы диагностики.
В настоящее время в 77 регионах РФ внедрен стандартизированный протокол обследования беременных женщин с целью ранней пренатальной диагностики хромосомных аномалий. Международный стандарт протокола обследования разработан Фондом медицины плода (FMF, Англия). Сроком такого скрининга установлен первый триместр беременности (период 11–13,6 недель), включающего ультразвуковое исследование плода и биохимический анализ материнских сывороточных маркеров. Ультразвуковые исследования проводятся только специалистами экспертного уровня, имеющими международный сертификат FMF, а определение сывороточных маркеров (РАРР-А и свободной бета-субъединицы ХГЧ) производится исключительно сертифицированными FMF анализаторами.
Для оценки индивидуального риска хромосомных аномалий используется программа Astraia, позволяющая (кроме оценки рисков) проводить внешний аудит ультразвуковых и биохимических измерений. Беременным женщинам, попавшим в группу высокого генетического риска (с пороговым значением до 1/100), проводится медико-генетическое консультирование и инвазивная пренатальная диагностика (ПД). При таком подходе значительно снижается число женщин, которым требуется проведение инвазивной диагностики, а вероятность выявления синдрома Дауна и других хромосомных заболеваний увеличивается до 95 %.
Целью настоящего исследования является анализ эффективности пренатальной диагностики на материале обследования беременных женщин, проживающих на территории Западного административного округа города Москвы и «новой» Москвы.
Материалы и методы
Проведен анализ результатов работы службы пренатальной диагностики родильного дома №3 за 2012–2014 годы. Работа по пренатальной диагностике проводилась в соответствии с приказами Департамента здравоохранения от 27 октября 2009 года № 1376 «О дальнейшем совершенствовании организации пренатальной диагностики врожденной и наследственной патологии» и от 14 июня 2013 года № 600 «О совершенствовании организации пренатальной (дородовой) диагностики нарушений развития плода/ребенка». При этом следует учесть, что служба пренатальной диагностики в Москве находится на начальном этапе внедрения международного стандарта обследования беременных женщин.
Для расчета риска рождения ребенка с хромосомной патологией с учетом возраста матери, данных анамнеза, УЗИ и концентрации обоих сывороточных белков в 1 триместре использовалась программа «LifeCycle» (Perkin Elmer Life & Analytical Science, Wallac, Oy, P.O.Box 10 FIN-20101 Turku, Finland), поставщик ООО «Приборы Ой» (Москва). К группе беременных высокого риска рождения детей с хромосомной патологией относили пациенток при риске более чем 1 на 250. Женщины из группы высокого риска направлялись на консультацию врача-генетика в родильный дом № 3.
За период с 2012 по 2014 г. медико-генетическое консультирование на базе родильного дома № 3 проведено 1102 беременным женщинам. Необходимость в проведении инвазивной диагностике была определена для 341 женщины. 171 женщина (50,15 %), учитывая возможность добровольного обследования, отказались от проведения процедуры в настоящий момент. Инвазивная цитогенетическая диагностика проведена 170 беременным с учетом выявленных ультразвуковых и биохимических маркеров. Ультразвуковые исследования состояния плода проводились в сроке беременности 11–14 недель врачами-специалистами, имеющими допуск на проведение ультразвукового скринингового обследования в 1 триместре и специализирующихся на пренатальном выявлении врожденных пороков развития.
Родильный дом № 3 располагает необходимыми техническими и организационными возможностями для пренатального кариотипирования плода в целях исключения хромосомной патологии. Так, в зависимости от срока беременности применяются все методы инвазивной ПД для получения клеток плода и зародышевых оболочек: хорионбиопсия, амниоцентез и кордоцентез. Цитогенетическое исследование плодного материала проводится врачом-цитогенетиком генетической службы Научно-практического центра медицинской помощи детям.
Результаты и обсуждение
С момента организации медико-генетического консультирования в роддоме № 3 (период 2012–2014 гг.) за соответствующей помощью обратились 1102 женщины в периоде беременности 1-го и 2-го триместра.
Среди беременных с высоким риском, обратившихся к врачу-генетику, причины обращения распределились следующим образом: женщины, обратившиеся по результатам биохимического скрининга сывороточных маркеров (52,6 %), женщины старше 35 лет (24,6 %) и женщины, имеющие ультразвуковые (УЗ) маркеры хромосомной патологии у плода (11,4 %), а также по иным причинам (см. рис. 1).
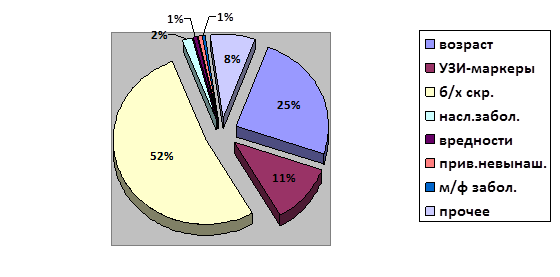
Рис. 1. Структура патологии беременности в зависимости от причины обращения
В результате обращения сформирована группа женщин с высоким риском хромосомной патологии у плода, которым показано проведение инвазивной ПД. Инвазивная ПД рекомендована в 341 случае. Из них 156 (45,7 %) женщин отказались от исследования по психологическим и религиозным причинам. Около 1,5 % женщин имели медицинские противопоказания к проведению инвазивной пренатальной диагностики, 3 % женщин выразили желание проводить диагностику в других лечебных учреждениях.
Всего было проведено 170 инвазивных ПД. Биопсия хориона (плаценты) в 1-м триместре беременности с целью кариотипирования плода составила 8,2 % от всех исследований. Большое количество инвазивных вмешательств пришлось на амниоцентез (88,2 %), проводимый во 2-м триместре беременности. Кордоцентез (2-й триместр) составил 3,5 %. Пренатальная диагностика с помощью кордоцентеза проведена только в случаях выявления поздно манифестирующих пороков развития по результатам ультразвукового исследования плода.
Следует отметить, что хорионбиопсия с последующим кариотипированием ворсин хориона в первом триместре беременности имеет важное преимущество перед другими инвазивными методами, так как позволяет получить быстрый ответ и, при необходимости, прервать беременность еще на ранних сроках с наименьшим риском для здоровья женщины.
По рекомендациям международного стандарта FMF в структуре всех пренатальных инвазивных процедур доля самой ранней по срокам проведения хорионбиопсии должна составлять не менее 60 %, а доля кордоцентезов – не более 2 %. Кордоцентез, как наиболее значимая по осложнениям манипуляция, может проводиться только в исключительных случаях с целью выбора тактики ведения беременности и родоразрешения с учетом состояния матери и состояния (заболевания) плода [1].
В нашем исследовании небольшое количество хорионбиопсии связано со сниженной эффективностью организации пренатальной диагностики в женских консультациях ЗАО города Москвы. Такая картина обусловлена поздними сроками постановки на учет в женских консультациях беременных женщин, что снижает возможность их информированности о генетических рисках. Так, в большинстве случаев женщины из группы высокого генетического риска получали медико-генетическое консультирование во втором триместре беременности, что приводило к поздней диагностике хромосомных аномалий у плода, а в ряде случаев и к отказу пациенток от инвазивных процедур.
За истекшие 2,5 года по результатам 170 инвазивных пренатальных диагностик выявлено 26 хромосомных аномалий, то есть эффективность инвазивной ПД составила 15,3 %. По результатам 2008–2009 годов данный показатель по РФ в среднем составил 8,7 % [2].
Между тем по данным международного стандарта FMF, инвазивная ПД считается достаточно эффективной, если она достигает 15 % и выше. По итогам федерального аудита за 2012 и 2013 годы, проведенного в регионах РФ, где был внедрен международный стандарт ранней ПД, средний показатель эффективности инвазивной ПД составил 28,3 % и 28 % соответственно, в Московской области – 35 % [2,3].
Таким образом, приведенные сравнительные данные показывают, что современный алгоритм проведения пренатального скрининга является наиболее эффективным методом массового обследования беременных женщин.
Часто встречаемый и наиболее сложный для пренатальной диагностики из всех хромосомный аномалий является синдром Дауна. В нашем исследовании было выявлено 24 плода с синдромом Дауна, 1 плод с синдромом Эдвардса и 1 плод с полисомией по У-хромосоме. Показания для применения инвазивных методов пренатальной диагностики и результаты представлены в таблице 1.
Таблица 1
Показания к проведению инвазивной пренатальной диагностики и результаты
|
показания |
количество инвазивных процедур |
хромосомная патология у плода |
|
Возраст (>35 лет) |
15 |
полисомия по У-хромосоме - 1 |
|
УЗ-маркеры |
32 |
с.Дауна - 2 |
|
высокий риск ХА по б/х скринингу |
54 |
с.Дауна - 2 |
|
возраст + УЗ-маркеры + б/х скр. |
12 |
с.Дауна - 8 |
|
возраст + б/х скрининг |
42 |
с.Дауна - 8 |
|
УЗ-маркеры + б/х скрининг |
13 |
с.Дауна – 4 с.Эдвардса – 1 |
|
мозаицизм, огранич. плацентой |
2 |
- |
|
ВСЕГО |
170 |
26 |
Риск многих хромосомных заболеваний у плода возрастает с увеличением возраста матери. Женщины 35 лет и старше составляют самую многочисленную группу среди беременных, которым поводится инвазивная пренатальная диагностика, хотя удельный вес этих женщин находится в пределах 5 % от общего числа в популяции.
Средний возраст женщин с выявленной хромосомной патологией плода составил 36,8 лет (среди женщин с патологией плода синдромом Дауна – 36,5 лет). В 33,3 % случаев трисомия по 21 паре хромосом была выявлена у плодов женщин возрастной группы 35–40 лет; в 33,3 % случаев среди женщин старше 40 лет и в 33,3 % случаев среди женщин моложе 35 лет.
У женщин в возрасте до 35 лет, имеющих высокий индивидуальный риск хромосомных аномалий у плода по результатам биохимического скрининга сывороточных маркеров (программа LifeCycle), хромосомные аномалии были выявлены только в двух случаях.
Сочетание ультразвуковых маркеров с возрастным фактором (>35 лет) и/или с измененным биохимическим скринингом сывороточных маркеров значительно повышали эффективность инвазивной ПД. В нашем исследовании в данных случаях показатель эффективности инвазивной ПД достигал 52 % (рис. 2).

Рис. 2. Эффективность инвазивной ПД при различных показаниях к ее проведению
Наиболее ценным УЗ маркером хромосомных аномалий по праву считается толщина воротникового пространства (ТВП). В нашем исследовании ТВП у плодов с синдромом Дауна в сроке гестации 11–13,6 недель имела значения от 1 мм до 5,0 мм. Среди женщин с синдромом Дауна у плода в 12 случаях из 24 (50 %) были выявлены ультразвуковые маркеры хромосомной патологии в первом триместре беременности в виде расширения воротникового пространства. Вместе с тем расширение воротникового пространства наблюдалось в 30 случаях. То есть в 18 (60 %) случаях не было выявлено хромосомных аномалий у плода. Нормальный кариотип при увеличении ТВП у плода нельзя однозначно расценивать положительно.
Как уже отмечалось другими исследователями, расширение воротникового пространства является типичным фенотипическим проявлением, характерным не только для хромосомных аномалий, но и для врожденных пороков развития (ВПР) [5]. Наиболее часто из ВПР регистрируются врожденные пороки сердца и скелетные дисплазии [4].
В настоящее время пренатальное выявление синдромальной патологии у плодов с УЗ-маркерами или ВПР является сверхзадачей, и в некоторых случаях нам может оказать значительную помощь современные методы исследования. Использование хромосомного микроматричного анализа (ХМА) в пренатальной диагностике группой исследователей Wapner R.J. et al. позволило определить дополнительные клинически значимые отклонения у 6 % плодов, имеющих УЗ-маркеры и нормальный кариотип [6].
Одной из основных задач врача-генетика является выбор правильного метода подтверждающей диагностики. Помимо двух, ставших уже классическими, методов изучение хромосомных аномалий – кариотипирования и флуоресцентной гибридизации in situ (FISH-метод), в последнее время большее распространение получают методы на основе технологии ХМА. Каждый из перечисленных методов диагностики имеет свои показания к применению и также ограничения. ХМА обладает наибольшей информативностью, но не позволяет определить сбалансированные хромосомные перестройки и инверсии. Для их обнаружения все еще используют кариотипирование. ХМА, как и многие другие современные высокопроизводительные методы исследования, позволяет получить большое количество информации о хромосомных аберрациях, однако клиническая значимость только части из них далеко не всегда описана.
Когда речь заходит только о выявлении анеуплоидий, то помимо кариотипирования возможно использование мультиплексной амплификации лигированных зондов (MLPA в англоязычной литературе), количественный флуоресценцентный ПЦР (QF-PCR), анализ коротких тандемных повторов (STR).
Необходимо также отметить, что использование высокочувствительных молекулярных методов при диагностике по ткани хориона и плаценты может привести к повышению числа ложноположительных результатов, а также результатов с большой степенью неопределенности прогноза. Причиной подобных трудностей является большое накопление патологических мутаций в ткани плаценты, по сравнению с плодовыми клетками. Большее содержание плодовых клеток имеется в амниотической жидкости; амниоциты намного точнее отражают генетический статус плода по сравнению с клетками трофобласта. Применение методов молекулярного кариотипирования, очевидно, будет более информативно при проведении амниоцентеза в начале II триместра беременности по сравнению с хорион- и плацентобиопсией.
В связи с интенсивным развитием методов высокопроизводительного секвенирования на сегодняшний день в ряде стран мира применяются методы неинвазивного пренатального генетического тестирования часто встречаемых анеуплоидий по фрагментированной внеклеточной ДНК плода в крови матери.
Заключение
Успешная реализация массового раннего пренатального скрининга возможна только при четкой организации совместной работы врачей женских консультаций, кабинетов пренатальной диагностики, лаборатории, осуществляющей биохимический скрининг, врачей-генетиков и специалистов лабораторий пренатальной диагностики. Дальнейшего развития и совершенствования требует цитогенетическая составляющая службы ПД. В целях повышения диагностических возможностей и для сокращения сроков получения результатов генетических анализов необходимо внедрять в работу лабораторий пренатальной диагностики новые методы исследования, такие как хромосомный микроматричный анализ и метод количественной ПЦР (QFPCR).
Для достоверной оценки результатов ранней пренатальной диагностики также необходимо организовать систему «обратной связи», с помощью которой служба пренатальной диагностики сможет получать сведения об исходах беременностей и родов ребенком с генетическими нарушениями и пороками развития, проводить анализ своей работы, разрабатывать и внедрять методы оптиматизации ПД.
Рецензенты:
Зинченко Р.А., д.м.н., профессор, заведующая лабораторией генетической эпидемиологии ФГБУ «Медико-генетический научный центр» Российской академии медицинских наук, г. Москва.
Петрин А.Н., д.м.н., профессор, заведующий лабораторией медицинских генетических технологий ГБОУ ВПО Московский государственный медико-стоматологический университет им. А.И. Евдокимова Минздравсоцразвития России, г. Москва.



