Гемоглобин – гемопротеид, является основной составной частью эритроцитов и обеспечивает дыхательную функцию крови, осуществляя перенос кислорода от легких к тканям и обратный транспорт углекислого газа от тканей в органы дыхания [1]. Молекула гемоглобина состоит из белка – глобина (96% от массы молекулы) и небелковой простетической группы, называемой гемом (4% от массы молекулы). Гемоглобин – олигомерный белок, состоит из четырех полипептидных цепей, молекулярная масса гембелка составляет 66.800–68.000 Да [2].
В настоящее время актуальными являются исследования, направленные на выявление воздействия разных физико-химических агентов, а также лекарственных средств на структурно-функциональные свойства белков в организме. Лекарственные средства можно рассматривать как своеобразные реагенты, которые, будучи введенными в организм, способны вызывать изменения в структуре ферментов, клеточных мембран, рецепторов и других биополимеров, составляющих молекулярную основу жизни. Детальное исследование взаимодействия лекарства с белками-ферментами и их надмолекулярными комплексами имеет большое значение для выявления механизмов их лекарственного и побочного действия на биосистемы.
Гемоглобин является удобной моделью для изучения влияния различных агентов на белки, в частности на ферменты, так как простетическую группу данного гемопротеида – гем – можно рассматривать как аналог активного цента. Галоперидол – антипсихотический препарат, применяемый при шизофрении, бредовых расстройствах и других заболеваниях, сопровождающихся галлюцинациями, психомоторным возбуждением. Фармакологический эффект галоперидола связан с блокадой центральных дофаминовых, серотониновых и альфа-адренергических рецепторов в мезокортикальных и лимбических структурах головного мозга. Легкость проникновения лекарства через мембрану определяется липофильностью галоперидола [4]. Так как один из этапов пребывания галоперидола в организме связан с поступлением его в кровь и связыванием с ее белками и форменными элементами, целесообразным представляется исследование влияния данного нейролептика на функционирование гемоглобина.
Целью исследования явилось изучение структурно-функциональных изменений гемоглобина, индуцированных воздействием галоперидола.
Материалы и методы
В опытах использовали растворы оксигемоглобина (HbО2) в 0,1 моль/л натрий-фосфатном буфере (рН = 7,4), полученные из крови взрослых доноров, и растворы галоперидола в натрий-фосфатном буфере (рН 7,4) с концентрациями модификатора 1×10-6, 1×10-5, 1×10-4 моль/л соответственно. Буферные растворы HbО2 имели концентрацию 1×10-4 моль/л. Для получения растворов оксигемоглобина использовали метод Драбкина с модификацией Блюменфельда [3]. Регистрацию кривых диссоциации оксигемоглобина (КДО) осуществляли спектрофотометрическим методом при λ = 430 Нм (полоса Соре дезоксиформы). В качестве образца сравнения использовали светорассеивающую пластину, что позволило исключить вклад рассеяния света суспензией [2]. Образцы хранили в холодильнике при t +40C не более 2 ч. Регистрацию спектров поглощения нативного и модифицированного галоперидолом гемоглобина проводили спектрофотометрически на СФ-26. Определение молекулярной массы проводили с помощью метода гель филитрации на сефадексе G-100 [5].
Полученные результаты и их обсуждение
Регистрация КДО – метод, позволяющий получить ценную информацию о структурно-функциональном состоянии гемоглобина. Поэтому данный метод нашел широкое применение в различных областях биологии и медицины. КДО показывает зависимость насыщения гемоглобина О2 от парциального напряжения О2. Важными показателями, характеризующими процесс обратимого связывания кислорода гемоглобином, являются значения Р50, т.е. парциальное давление кислорода, при котором гемоглобин насыщен им на 50%, и константа Хилла (α), отражающая степень гем-гемового взаимодействия субъединиц в олигомере [2].
Нами были зарегистрированы КДО оксигемоглобина, модифицированного галоперидолом при соотношении молекул 1:1.
Анализ данных, представленных на рисунке 1, показывает, что добавление галоперидола в указанных концентрациях повышает сродство гембелка к кислороду, при этом модифицирующее действие нейролептика носит выраженную концентрационную зависимость. Минимальная из использованных концентраций галоперидола индуцирует снижение значения Р50 с 22,8±1,04 до 17,5±0,51 мм рт. столба. Последующее увеличение концентрации до 1×10-5 и 1×10-4 моль/л приводит к дальнейшему повышению сродства гембелка к кислороду (Р50 составляет 13,1±1,3 и 12,6±2,5 мм рт. столба соответственно). Вероятно, под воздействием данного лекарственного вещества усиливается способность кислорода связываться с железом гема.
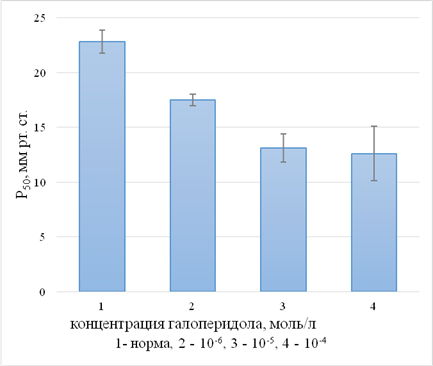
Рис.1. Изменение значений Р50 при действии галоперидола
Модификация HbО2 галоперидолом находит отражение и в уровне кооперативного взаимодействия субъединиц в составе тетрамера. Зависимость значения константы Хилла от концентрации нейролептика носит сложный характер (рис. 2).
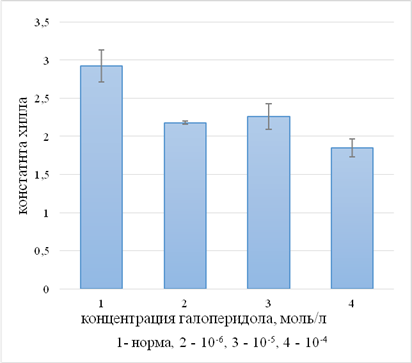
Рис. 2. Изменение значений константы Хилла α при действии галоперидола
При использовании галоперидола в концентрации 1×10-6 моль/л величина α снижается с 2,92±0,21 (контроль) до 2,18±0,02. Последующее увеличение концентрации модификатора до 1×10-5 моль/л не вызывает статистически достоверных изменений α, которое составляет 2,26±0,17. В случае использования максимальной из использованных концентраций галоперидола наблюдается существенное снижение константы Хилла α до 1,85±0,12. Понижение величины α свидетельствует об ослаблении кооперативного эффекта, что может быть объяснено структурными нарушениями в области контакта субъединиц.
С целью получения информации о структурном состоянии гемоглобина (С = 1×10-4 моль/л), модифицированного галоперидолом (С = 1×10-6, 1×10-5, 1×10-4 моль/л), использовали метод гель-хроматографии, который является одним из современных хроматографических методов выделения, очистки и анализа биологических макромолекул. Результаты экспериментов показали, что модифицированный белок выходит из гель-фильтрационной колонки, упакованной сефадексом G-100 и уравновешенной 0,1 моль/л натрий-фосфатным буфером, рН 7,4, одной фракцией с молекулярной массой 66.000 ±1000 Да.
Полученные данные свидетельствуют о сохранении целостностности (тетрамерности) молекул гемоглобина, модифицированного лекарственным веществом, т.е. разрыва связей между субъединицами гемопротеида и образования низкомолекулярных форм не происходит.
Полученные данные показывают, что галоперидол оказывает воздействие на гемоглобин, что находит отражение в изменении основных макрохарактеристик его кислородсвязывающей способности. При этом выявленные нарушения функциональной активности гембелка при действии галоперидола обусловлены, по-видимому, конфирмационными перестройками апобелковой части молекулы, затрагивающей, вероятно, области субъединичных контактов.
С целью выявления молекулярных механизмов взаимодействия нейролептика с гемоглобином методом абсорбционной спектрофотометрии нами были исследованы спектральные свойства растворов оксигемоглобина, модифицированных галоперидолом в объемном соотношении 1: 1.
Спектр контрольного раствора оксигемоглобина характеризуется в видимой области тремя полосами поглощения, очень интенсивной при λ = 412 Нм (полоса Соре) и менее интенсивными длинноволновыми полосами при λ = 542 и λ = 576 Нм. В УФ-области спектра регистрируются две отчетливые полосы при λ = 278 Нм и λ = 342 Нм. При анализе спектров поглощения в УФ и видимой области было отмечено, что галоперидол во всех выбранных концентрациях индуцирует снижение оптической плотности, т.е. интенсивность всех полос поглощения гемопротеида, однако смещения полос не происходит, так как λmaх не изменяется. При концентрации лекарства 1×10-4 моль/л снижение оптической плотности было более выражено для всех полос поглощения (таблица).
Значения величины оптической плотности (D) основных полос поглощения растворов оксигемоглобина, модифицированного галоперидолом
в концентрациях 1×10-6, 1×10-5, 1×10-4 моль/л.
|
|
D278 Нм |
D342 Нм |
D412 Нм |
D542 Нм |
D576 Нм |
|
Нативный раствор HbО2 |
0,73±0,02 |
0,54±0,03 |
2,28±0,30 |
0,28±0,02 |
0,29±0,02 |
|
HbО2 + галоперидол (С = 1×10-6 моль/л) |
0,61±0,03* |
0,45±0,02* |
1,90 ±0,20 |
0,25±0,03 |
0,27±0,03 |
|
HbО2 + галоперидол (С = 1×10-5 моль/л) |
0,55±0,03* |
0,41±0,03* |
1,74±0,30 |
0,20±0,02* |
0,25±0,02 |
|
HbО2 + галоперидол (С = 1×10-4 моль/л) |
0,49±0,02* |
0,39±0,02* |
1,65±0,20* |
0,18±0,01* |
0,21±0,02* |
Примечание: * - отличие от нормы достоверно (уровень значимости Р<0,05)
Регистрируемое снижение величины D при λ = 278 Нм указывает на уменьшение интенсивности глобиновой полосы поглощения, что может быть обусловлено возможным взаимодействием ароматических участков молекулы нейролептика с хромофорами белка. Результатом взаимодействия может быть частичное экранирование аминокислотных остатков тирозина, триптофана и фенилаланина, а также возможное перераспределение электронной плотности между взаимодействующими компонентами. Также было установлено, что действие галоперидола в использованных концентрациях не индуцирует образования метгемоглобина, так как характерных для метгемоглобина максимумов при λ = 405 Нм и λ = 630 Нм не зарегистрировано. Таким образом, галоперидол оказывает на молекулу гемоглобина модифицирующее действие, вызывая конфирмационные изменения в гембелке. Степень модификации гемоглобина зависит от концентрации лекарственного вещества.
Спад интенсивности поглощения полос указывает на то, что в присутствие галоперидола структурным превращениям подвергается как гемовый, так и глобиновай компонент молекулы оксигемоглобина.
Выводы
В заключение можно сделать вывод, что наблюдаемый сдвиг КДО влево при воздействии лекарственного препарата свидетельствует о повышении сродства гемоглобина к кислороду и затруднению отдачи кислорода тканям. Характер изменений величины Р50 и α позволяет предположить, что при использовании высоких концентраций галоперидола преимущественную роль приобретают конфирмационные перестройки третичной структуры гембелка. Также установлено, что под воздействием галоперидола не происходит разрыва связей внутри молекулы гембелка.
Рецензенты:
Яковлев А.Н., д.м.н., профессор кафедры нормальной физиологии ВГМА им. Н.Н. Бурденко, г. Воронеж;
Звягин А.А., д.м.н., профессор кафедры пропедевтики детских болезней и педиатрии ВГМА им. Н.Н. Бурденко, детская клиническая больница ВГМА им. Бурденко, г. Воронеж.



