Трансплантация остается преимущественно единственным методом лечения пациентов в терминальной стадии заболеваний легких [5]. Однако необходимость использования органного донорства сопряжена с проблемами этического характера, проведением пожизненной иммуносупрессивной терапии и высокой частотой неблагоприятных исходов в послеоперационном периоде [1; 5]. Тканевая инженерия предлагает принципиально новый подход к проведению аллотрансплантации легких, применение которого в клинической медицине в перспективе позволит избежать негативных эффектов иммуносупрессивной терапии и значительно снизит потребность в донорских органах. Концептуально тканевая инженерия легких основывается на получении биологического каркаса путем полного удаления клеток (децеллюляризации) с сохранением трехмерной структуры нативного органа. В последующем указанный каркас засеивается аутологичными клетками реципиента, что исключает потребность в проведении иммуносупрессивной терапии [2].
Децеллюляризация легких может проводиться механическим, физическим, химическим способами и их комбинациями [2; 3]. В частности, широко применяется детергентно-энзиматический метод с использованием различных растворов детергентов и разной продолжительностью времени их воздействия [3-8]. В то же время проблема сохранения структуры ВКМ после воздействия химических агентов остается актуальной и диктует необходимость разработки щадящих методов децеллюляризации легких с воссозданием физиологических условий вентиляции и перфузии каркасов [4-8].
Целью настоящего исследования явилась разработка оптимального протокола децеллюляризации легких крысы с последующей морфологической оценкой структуры ВКМ.
Материал и методы
Оптимальный протокол децеллюляризации легких крысы разрабатывался на 25 взрослых беспородных крысах-самцах весом 180±16 г. Все исследования на животных проводились в лаборатории международного научно-исследовательского клинико-образовательного центра регенеративной медицины на базе Кубанского государственного медицинского университета после одобрения протокола исследования локальным этическим комитетом. Основную группу составили 20 животных, в зависимости от протокола проведения децеллюляризации разделенные на подгруппы: (1) с вентиляций легких атмосферным воздухом через трахею при одновременной перфузии аорты растворами детергентов; (2) с вентиляцией атмосферным воздухом через трахею на фоне перфузии легочной артерии; с проведением перфузии растворами детергентов через (3) аорту или (4) легочную артерию без симультанной вентиляции легких. Пять животных составили контрольную группу для оценки морфологической структуры нативных легких.
Подготовка органокомплекса и проведение децеллюляризации
Перед оперативным вмешательством животным интраперитонеально вводили летальную дозу барбитуратов (150 мг/кг), за час до операции выполняли инъекцию гепарина в дозе 100 ЕД. Эксплантацию органокомплекса «сердце - легкие» проводили единым блоком после выполнения стернотомии. В стерильных условиях органокомплекс очищали от окружающей соединительной ткани и жировой клетчатки и промывали раствором фосфатного буфера с добавлением 1%-ного раствора пенициллина-стрептомицина. Трахею и аорту (или легочную артерию, в зависимости от протокола) канюлировали на расстоянии 2,5-3 см от устья. Органокомплекс фиксировали в биореакторе для последующей перфузии 1%-ным раствором пенициллина-стрептомицина в фосфатном буфере в течение 1 часа; деионизированной водой – 1 час; 1%-ным водным раствором дезоксихолата натрия с добавлением 0,002М натриевой соли ЭДТА ‒ 2 часа; деионизированной водой – 30 мин.; 0,1%-ным раствором Тритона Х-100 в течение 1 часа; 1%-ным раствором пенициллина-стрептомицина в фосфатном буфере - 1 час, свиной панкреатической ДНКазой I (2000 ЕД фермента на 200 мл фосфатного буфера с добавлением кальция и магния) – 3 часа. Завершали децеллюляризацию воздействием 1%-ного раствора пенициллина-стрептомицина в фосфатном буфере в течение 12 часов. Подгруппам (1) и (2) проводили вентиляцию легких атмосферным воздухом с помощью системы Harvard Inspira Advanced Safety Ventilator (Harvard Apparatus, Массачусетс, США).
Морфологическая оценка децеллюляризированного матрикса
Образцы нативных и децеллюляризированных легких фиксировали в 10%-ном нейтральном забуференном формалине, дегидратировали и заключали в парафин по стандартной методике с использованием автоматического гистопроцессора Leica TP1020 (Германия) и модульной установки Leica EG1150H (Германия). Парафиновые срезы толщиной 5 мкм, полученные при помощи ротационного микротома Leica RM2235 (Германия), депарафинизировали и гидратировали с последующим окрашиванием гематоксилином и эозином и флуорофором (4’,6-диамидино-2-фенилиндола) DAPI. Качественную оценку содержания гликозаминогликанов и эластических волокон в образцах проводили после окрашивания срезов альциановым синим и пикрофуксином по Ван Гизону соответственно. Белки ВКМ визуализировали при проведении иммуногистохимического анализа. В качестве первичных антител были выбраны мышиные моноклональные антитела к ламинину (ab11575, Abcam, Англия), эластину (ab21610, Abcam, Англия), фибронектину (ab6328, Abcam, Англия), коллагену IV типа (ab6586, Abcam, Англия), коллагену I типа (ab34710, Abcam, Англия).
Ультраструктуру нативных и децеллюляризированных легких крысы оценивали при помощи сканирующего электронного микроскопа JSM6490, JEOL (Япония) после подготовки по стандартной методике: фиксации в 2,5%-ном растворе глютеральдегида (Мerk, Германия) в 0,1 М какодилатном буфере (Prolabo, Франция) с последующим промыванием, обезвоживанием в спиртах, высушиванием и напылением золотых частиц.
Количественное определение содержания ДНК в образцах легких, децеллюляризированных по 4 протоколам, определяли на спектрофотометре NanoDrop ND-1000 (Thermo Fisher Scientific Inc., США) с использованием набора реагентов (Dneasy Blood and Tissue Kit, Qiagen, Швеция) по стандартной методике фирмы-изготовителя.
Результаты и их обсуждение
Ориентировочным макроскопическим критерием завершения процесса децеллюляризации явилось изменение насыщенно-розовой окраски легких на молочно-белую. Среднее время выполнения децеллюляризации составило 35±7 часов. При этом наибольшую длительность протокола отмечали в подгруппах (3) и (4) – 36 и 48 часов соответственно, наименьшую – 23 часа – в подгруппе (2). Рутинные методы гистологической окраски выявили значительные повреждения альвеолярной структуры в образцах, полученных в подгруппах (1) и (3), что связывали с ретроградным направлением перфузии. В то же время количество клеточных элементов, выявляемых как при окрашивании гематоксилином и эозином, так и при окрашивании флуорофором DAPI, а также уровень резидуального ДНК не позволял говорить об эффективности децеллюляризации, проведенной по протоколам (1), (3) и (4). В легких, децеллюляризированных по протоколу (2), при окрашивании микропрепаратов гематоксилином и эозином клеточные ядра и структуры не были визуализированы, повреждения альвеолярной структуры, несмотря на принудительную механическую вентиляцию, выражены незначительно. Окрашивание DAPI и определение процентного содержания остаточной ДНК подтверждало высокое качество децеллюляризации (рис. 1).
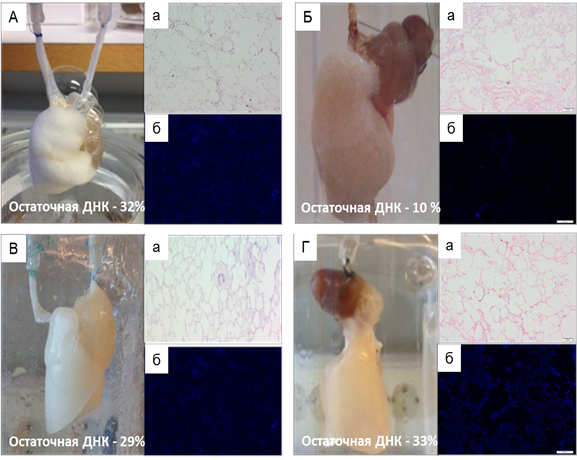
Рис. 1. Сравнительный анализ протоколов децеллюляризации легких крысы: А -подгруппа (1), Б - подгруппа (2), В - подгруппа (3), Г - подгруппа (4); а - окрашивание гематоксилином и эозином; б – окрашивание DAPI. Увеличение: об х10; ок. х10.
Окрашивание пикрофуксином по Ван Гизону позволило визуализировать сохранность архитектоники соединительных волокон ВКМ, слабокислые сульфатированные гликозаминогликаны были выявлены по положительному окрашиванию срезов альциановым синим (рис. 2).

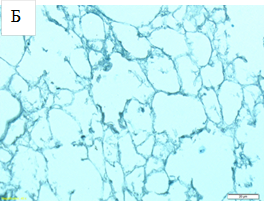
Рис. 2. Децеллюляризированные легкие, подгруппа (3). Окрашивание пирофуксином по Ван Гизону (А), окрашивание альциановым синим (Б). Увеличение: об х40; ок. х10.
Иммуногистохимический анализ компонентов ВКМ не показал качественных изменений его состава: ориентация и структура волокон патологически изменена не была. Ламинин, фибронектин и коллаген IV типа располагались преимущественно в базальных мембранах легочных сосудов и бронхов, в то время как эластин и коллаген I типа - в строме нативных и децеллюляризированных легких (данные не представлены).
Сканирующая электронная микроскопия (СЭМ) альвеолярной и плевральной поверхностей легких, децеллюляризированных по протоколу (2), выявила полное отсутствие клеточных элементов при сохранении ультраструктуры альвеол по сравнению с данными, полученными для нативных легких (рис. 3).


Рис. 3. СЭМ нативных (А) и децеллюляризированных легких (Б). Альвеолярная поверхность. Увеличение х1500.
Заключение
Детергентно-энзиматический метод децеллюляризации легких путем перфузии растворов через легочную артерию в сочетании с вентиляцией трахеи атмосферным воздухом представляется наиболее перспективным способом получения биологических каркасов для создания тканеинженерных легких.
Работа финансирована грантом Правительства Российской Федерации для государственной поддержки научных исследований, проводимых под руководством ведущих ученых в российских образовательных учреждениях высшего профессионального образования от 19 октября 2011 г. № 11.G34.31.0065.
Рецензенты:
Славинский А.А., д.б.н., профессор, заведующий кафедрой патологической анатомии ГБОУ ВПО «КубГМУ Минздрава России», г. Краснодар;
Павлюченко И.И., д.м.н., профессор, профессор кафедры клинической иммунологии, аллергологии и лабораторной диагностики ФПК и ППС ГБОУ ВПО «КубГМУ Минздрава России», г. Краснодар.



