Сколиоз – это развивающийся во времени процесс, клиническая симптоматика которого носит нарастающий (прогрессирующий) характер, при этом темп его прогрессирования в разные периоды жизни не одинаков [4]. Вследствие перегрузки хрящевой части позвоночника происходит медленное перманентное разрушение межпозвоночных суставов и дисков.
Межпозвоночный диск (МПД) является высокоспециализированной структурой. Из-за отсутствия кровеносных сосудов поступление нутриентов обеспечивается посредством диффузии, что делает его зависимым от структуры матрикса. Повреждение матрикса обусловливает изменение диффузии, в последующем – уменьшение количества клеток, обеспечивающих достаточное количество матриксных белков и гликозаминогликанов [3].
Проблема регенерации МПД является одной из актуальных в медицине и биологии, о чем свидетельствуют многочисленные исследования, посвященные разработке и изучению экспериментальных моделей его дегенеративно-дистрофических заболеваний [2].
Известны экспериментальные модели сколиоза и у растущих животных [1]. Однако в этих исследованиях не были изучены патоморфологические изменения в МПД на тканевом и клеточном уровнях их структурной организации. В литературе, посвященной экспериментальным моделям дегенеративно-дистрофических заболеваний МПД, также отсутствуют описания моделей, включающих рентгенографические и морфологические критерии оценки ключевых процессов дегенерации и регенерации его хрящевой ткани [2].
Цель исследования – анализ структурной реорганизации межпозвоночного диска при моделировании сколиоза у собак в период активного роста.
Материал и методы исследования
Исследование выполнено на 16 беспородных собаках обоего пола. Животным I–III серии опытов в четырехмесячном возрасте осуществляли моделирование сколиотической деформации поясничного отдела позвоночного столба. В I серии (n=4) – путем эндоскопической коагуляции спинальных ганглиев на 5 пояснично-двигательных сегментах (ПДС) – модифицированный метод Гайворонского с применением минимально инвазивной техники EasyGo. Во II серии опытов (n=4) осуществляли фиксацию смежных позвонков скобами из никелида титана с эффектом термохимической памяти формы. В III серии (n=4), наряду с аналогичными скобами из никелида титана, в субхондральную область пластинок роста позвонков с ипcилатеральной стороны дополнительно имплантировали титановые пластины, толщиной 0,3 мм [5]. Контрольную серию (n=4) составляли интактные собаки соответствующего возраста.
Экспериментальные исследования проведены в соответствии с требованиями «Европейской конвенции по защите позвоночных животных, используемых для экспериментальных и других научных целей» и были одобрены этическим комитетом ФГБУ «РНЦ «ВТО» им. академика Г.А. Илизарова.
Всем животным осуществляли рентгенографию с помощью рентгеновского аппарата «Premium Vet» (Sedecal, Испания) в дорсо-вентральной и латеральной проекциях до операции, после получения модели сколиотической деформации, а также после эвтаназии. Для оценки изменения формы позвоночного столба использовали метод рентгеновской морфометрии на 14, 30, 60, 90 и 180 сутки после проведенного вмешательства.
Животных выводили из эксперимента через 180 суток после операции.
Выполнено гистологическое исследование МПД на уровне вершины деформации – LIV-LV. Материал проводили по стандартной методике, парафиновые срезы окрашивали гематоксилином и эозином, по Массону, альциановым синим при разных рН (гистохимическая реакция на гликозаминогликаны). Кроме того, готовили полутонкие эпоксидные срезы, которые окрашивали метиленовым синим-основным фуксином и толуидиновым синим. Для микроскопии отбирались все зоны хряща: фиброзное кольцо, переходная зона, пульпозное ядро. Препараты исследовали на фотомикроскопе (Оpton, Германия). Гистологические исследования выполнены с помощью комплекса цифровой микроскопии «ДиаМорф» (ДиаМорф, Россия) и программы «ВТ-Мастер-Морфология» (ВидеоТест, Россия).
Статистическую обработку осуществляли общепринятым методом с вычислением средней арифметической (M) и стандартной ошибки среднего (m) в редакторе электронных таблиц «Microsoft Office Excel 2010» (Microsoft Corporation, США), включающем надстройку «AtteStat 13.1» (И.П. Гайдышев, Россия).
Результаты исследования и их обсуждение
При анализе рентгенограмм пояснично-крестцового отдела позвоночного столба у всех животных на первые сутки эксперимента деформация позвоночника не выявлялась.
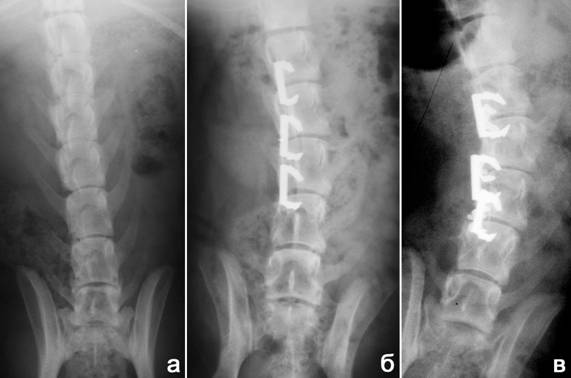
У животных I серии рентгенографические признаки сколиотического искривления позвоночного столба (клиновидность дисков, угловое смещение позвонков во фронтальной плоскости, проекционное смещение остистых отростков на вогнутую сторону, изменение соотношений между боковыми отростками) появлялись на 30 сутки наблюдения. При этом с момента возникновения бокового отклонения оси позвоночного столба также определялась ротация поясничных позвонков. Искривление позвоночного столба всегда было направлено в сторону ганглиотомии, локализовалось на уровне последней, а также распространялось на один сегмент выше и ниже от крайних поврежденных спинальных ганглиев (рис. 1).
|
|
|
Рис. 1. Рентгенограммы пояснично-крестцового отдела позвоночного столба собаки в прямой проекции через 180 суток после операции: а – при эндоскопической коагуляции спинальных ганглиев, б – с фиксированными ПДС скобами из никелида титана, в – с фиксированными ПДС скобами из никелида титана с пластинами установленных в метоэпифизарных зонах смежных позвонков |
У животных II и III серий уже на 14 сутки наблюдения отмечалось изменение формы МПД и позвонков, характерное для сколиоза, с боковым отклонением оси позвоночного столба. Вместе с тем темпы формирования и степень выраженности деформации во всех сериях эксперимента были различны (рис. 1, таблица).
Величина деформации позвоночного столба у собак, град. (М±m)
|
Серия опытов |
Срок наблюдения, сут |
||||
|
14 |
30 |
60 |
90 |
180 |
|
|
I |
– |
3,8±0,17 |
4,6±0,18 |
7,3±0,23 |
9,6±0,24 |
|
II |
3,2±0,12 |
6,3±0,27 |
7,3±0,11 |
12,4±0,28 |
17,3±0,16 |
|
III |
5,1±0,18 |
8,5±0,31 |
10,5±0,39 |
27,6±0,26 |
34,2±0,18 |
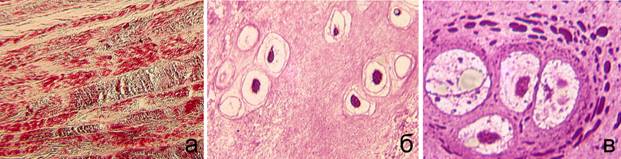
При патогистологическом исследовании МПД у животных I серии опытов было выявлено разволокнение и дезориентация коллагеновых волокон фиброзного кольца (ФК) (рис. 2 а). В переходной зоне (ПЗ) отмечались пустые лакуны и меньшая гомогенность изогенных групп, в которых часть хондроцитов с признаками деструкции (рис. 2 б). Такие клетки были уменьшены в размерах, цитоплазматические выросты не определялись, наблюдали явления гиперконденсации хроматина. В пульпозном ядре (ПЯ) была снижена интенсивность окраски основного вещества, выявлено формирование пустот. Преобладающей клеточной формой являлись хондроциты. Отмечена активная пролиферация, сопровождающаяся необратимыми дистрофическими изменениями клеток в изогенных группах. Цитоплазма хондроцитов была значительно выкуолизирована, наблюдались крупные жировые капли (рис. 2 в). В перицеллюлярной зоне выявлена высокая концентрация гранул секрета – как результат биосинтетической активности хондроцитов.
|
|
|
Рис. 2. Серия I. Срок эксперимента – 180 сут. а – разволокнение, формирование пустот в ФК. Парафиновый срезы, окраска по Массону. Об. 2,5; ок. 12,5. б – изогенные группы хондроцитов в ПЗ. Об. 40; ок. 12,5. в – хондроциты ПЯ на разных стадиях деструкции. Гранулы секрета в перицеллюлярной зоне. Об. 100МИ; ок. 12,5. |
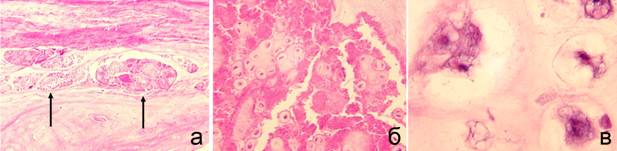
В МПД животных II серии опытов по сравнению с I серией разволокнение ФК было выражено интенсивнее. В дистрофически измененных коллагеновых волокнах внутреннего слоя ФК отмечено появление множества трещин и разрывов, в которые просачивалось ПЯ (рис. 3 а). На периферии ПЯ преобладали хондроциты, расположенные изогенными группами, основная часть клеток была в состоянии деструкции, отмечены участки некроза и формирование пустот (рис. 3 б). В центральной части диска преобладали нотохордальные клетки (рис. 3 в), по сравнению с возрастным контролем отмечено увеличение доли бесклеточных полей. Основное вещество ПЯ было слабо окрашено.
|
|
|
Рис. 3. Серия II. Срок эксперимента – 180 сут. Поперечный парафиновый срез МПД. Окраска гематоксилином и эозином. а – проникновение в ФК фрагментов деструктивно измененного ПЯ (стрелки). Об. 6,3; ок. 12,5. б – пролиферативно-деструктивные изменения периферических участков ПЯ, формирование пустот. Об. 16; ок. 12,5. в – нотохордальные клетки. Об. 40; ок. 12,5 |
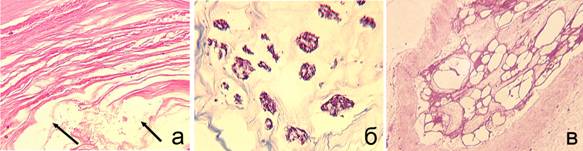
У животных III серии опытов было отмечено более интенсивное разволокнение ФК, чем в сериях I и II, наблюдали хаотичное расположение волокон, формирование пустот (рис. 4 а). Как и у животных II серии опытов выявлено проникновение ПЯ в трещины и разрывы ФК. В ПЯ основное вещество практически не окрашивалось, отмечены фрагментация и увеличение доли пустот (рис. 4 б). Основная часть хондроцитов и нотохордальных клеток была с признаками деструкции, их цитоплазма значительно вакуолизирована и содержала липиды (рис. 4 в).
|
|
|
Рис. 4. Серия III. Срок эксперимента – 180 сут. а, б – парафиновые срезы, окраска гематоксилином и эозином (а) и по Массону (б). а – разволокнение, формирование трещин в ФК. Пустоты в переходной зоне (стрелки). Об. 2,5; ок. 12,5. б – дистрофические изменения ПЯ, межклеточное вещество слабо окрашено, увеличение доли пустот. Об. 6,3; ок. 12,5. в – нотохордальные клетки с признаками деструкции. Полутонкие срезы, окраска метиленовым синим-основным фуксином. Об. 40; ок. 12,5 |
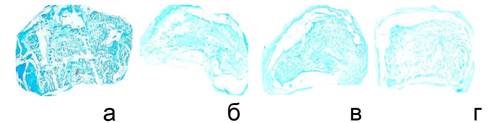
При гистохимическом исследовании сульфатированных гликозаминогликанов выявлено снижение интенсивности окраски пульпозного ядра во всех опытных сериях (рис. 5).
|
|
|
Рис. 5. Фрагменты пульпозного ядра, парафиновые срезы. Гистотопограммы. Снижение интенсивности гистохимической реакции на гликозаминогликаны, альциановый синий при рН 1,0. а – интактная серия, б – серия I, в – серия II, г – серия III |
Сравнительный анализ результатов рентгеноморфометрии позвоночного столба у животных всех опытных серий свидетельствует о более высоком темпе и выраженности сколиотической деформации позвоночного столба у животных с сегментарным блокированием субхондральной зоны позвонков. Этот факт подтверждает влияние сегментарного нарушения питания субхондральной области позвонков на формообразование позвонков и формирование сколиотической деформации позвоночного столба [7].
Патогистологическое исследование МПД во всех экспериментальных сериях выявило разволокнение коллагеновых волокон фиброзного кольца, дистрофические изменения основного вещества пульпозного ядра, снижение реакции на гликозаминогликаны, увеличение доли пустот в пульпозном ядре. Интенсивность деструктивных изменений увеличивалась от I до III серии опытов.
У животных после ганглиотомии, в отличие от серий с применением металлоимплантов, в пульпозном ядре исследованных МПД преобладали процессы гибели клеток над дистрофическими изменениями основного вещества, менее выражены изменения фиброзного кольца. Вероятно, в данной серии опытов основным патогенетическим фактором является нарушение адекватного питания клеток диска.
По данным H.A. Horner и J.P.G. Urban (2001), недостаточное нутриентное обеспечение является одним из важнейших факторов, способствующих возникновению дегенеративных изменений. Нарушение функции клеток приводит к изменению состава межклеточного вещества, что запускает и/или ускоряет дегенеративные процессы в диске. Клетки диска прекращают вырабатывать протеогликаны, гибнут, диск дегидратируется [8].
Одной из основных причин дегенерации МПД является неравномерное распределение нагрузки [3]. Однако в настоящее время прямая корреляция между появлением дегенеративных процессов, интенсивностью и частотой нагрузки на МПД не установлена. Напротив, с увеличением рациональной физической нагрузки увеличивается синтез протеогликанов [10].
По результатам патоморфологического исследования МПД, наиболее травматичной к 6 мес. эксперимента являлась модель формирования сколиоза поясничного отдела позвоночника скобами из никелида титана и металлическими пластинами (серия III). Это обусловлено, в том числе изменениями в ростковых зонах – травматизацией, нарушением васкуляризации в хрящевой пластинке, являющейся единственным источником поступления питательных веществ в ПЯ.
Заключение
В результате проведенного исследования изучена структурная реорганизация МПД при индуцированной сколиотической деформации позвоночного столба у собак в период активного роста. Полученные данные могут быть использованы для оценки адаптивно-структурных преобразований МПД при создании моделей сколиотической деформации в целях разработки и апробации новых и усовершенствования имеющихся методик ее хирургической коррекции.
Рецензенты:
Рябых С.О., д.м.н., зав. лабораторией патологии осевого скелета и нейрохирургии ФГБУ «Российский научный центр «Восстановительная травматология и ортопедия» им. академика Г.А. Илизарова» Минздрава РФ, г. Курган;
Шеин А.П., д.м.н., в.н.с. лаборатории патологии осевого скелета и нейрохирургии ФГБУ «Российский научный центр «Восстановительная травматология и ортопедия» им. академика Г.А. Илизарова» Минздрава РФ, г. Курган.