В настоящее время преэклампсию рассматривают как генетически детерминированный дефект адаптационных процессов материнского организма к развивающейся беременности [25,29]. Нет единого мнения о патогенезе преэклампсии. На практике используется множество профилактических мер, однако, частота и тяжесть преэклампсии не уменьшаются.
В конце 19, начале 20 века, был описан феномен ИАГ, и выявлено, что многие заболевания в хирургии, акушерстве и гинекологии связаны с данным феноменом [10,27]. Синдром ИАГ – это неспецифический синдром, к проявлениям которого относятся гиповолемия, почечная и печеночная недостаточности, нарушение сознания, сердечная недостаточность, что может быть расценено как проявление полиорганной недостаточности в контексте травматического повреждения, тяжелого инфекционного процесса, абдоминального сепсиса или сердечной недостаточности [8].
Множество теорий рассматривают преэклампсию как дезадаптацию материнского организма к развивающейся беременности из-за иммунных нарушений, генетической предрасположенности, генетически детерминированных эндокринных нарушений, наличия экстрагенитальной патологии. Однако ИАГ играет важную патогенетическую роль и в конечном итоге приводит к полиорганной недостаточности. В современном акушерстве особые прогностические маркеры развития и прогрессирования преэклампсии не определены. Нет эффективной профилактики и лечения преэклампсии. Лечение основано на интенсивной инфузионно-трансфузионной терапии и индуцированных родах (за счет декомпрессии).
Этиопатогенетическое и клиническое значение интраабдоминальной гипертензии
Нарушения гемодинамики, дыхания и почечной функции, связанные с ИАГ, были описаны в многочисленных работах, однако, понятие этиологии, патогенеза, диагностики и лечения абдоминального компартмент синдрома (АКС) были сформированы только в последнее время [8]. В зависимости от продолжительности развития ИАГ различают: хроническую ИАГ (развивается в течение нескольких месяцев во время беременности и годы при ожирении), подострую (в течение нескольких часов), острую (в течение нескольких минут) и сверхострую или молниеносную (в течение нескольких секунд).
Выделяют также 4 класса тяжести: класс I – 12–15 мм рт. ст.; класс II – 16–20 мм рт. ст.; III класс – 21–25 мм рт. ст.; класс IV – более 25 мм рт. ст. АКС наблюдается при ИАГ класса III–IV (больше 20 мм рт. ст.) с вытекающим снижением абдоминально-перфузионного давления (АПД) менее 50 мм рт. ст. и полиорганной недостаточностью [8].
Кровообращение в брюшной полости зависит от абдоминального перфузионного давления и определяется как разница между средним артериальным давлением (САД) и ВБД. Это изменение АПД, которые определяют развитие ишемии внутренних органов [8].
Уменьшение притока крови к органам развивается ранее и непропорционально снижению сердечного выброса.
На рис. 1 показаны кардиоваскулярные эффекты ИАГ и ее влияния на АПД
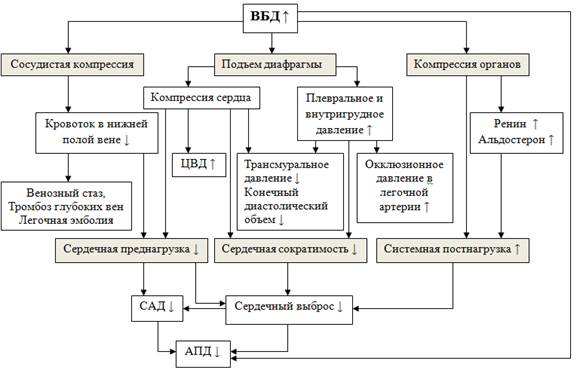
Рис. 1. Сердечно-сосудистые эффекты ИАГ и АПД – зависимость ИАГ
АПД – Абдоминально-перфузионное давление; ЦВД – центральное венозное давление; ВБД – внутрибрюшное давление; САД – среднее артериальное давление.
Сердечный выброс (СВ) зависит от ВБД (см. рис. 2).
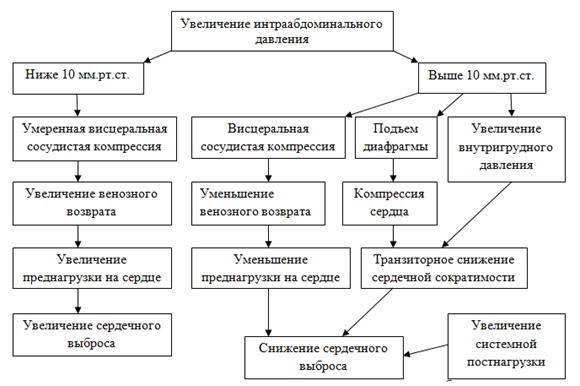
Рис. 2. Гемодинамические эффекты, вызванные увеличением ВБД
Преэклампсия как проявление интраабдоминальной гипертензии и синдром сердечно-сосудистой дезадаптации. Роль РАС в патогенезе преэклампсии
Согласно теории, предложенной Paramore, преэклампсия является разновидностью АКС и проявляется теми же симптомами: высокое артериальное давление, отеки, протеинурия, головные боли, тошнота и рвота [9,11,16].
Для преэклампсии характерны интраабдоминальная компрессия почек, мезентериальных и тазовых сосудов, венозная гиперемия и, как следствие, ишемия почек, маточно-плодово-плацентарного комплекса, печени и патологическая активация ренин-ангиотензиновой системы (РАС). Эти изменения могут быть результатом генетически обусловленных нарушений, эндокринной патологии и кардиоваскулярной дезадаптации [9,11,16,20]. По-видимому, причиной ИАГ при беременности является растущая матка, однако кардиоваскулярная дезадаптация и эндокринная дисфункция также могут играть определенную роль, особенно при патологической беременности [18].
При развитии ИАГ почки страдают в первую очередь. Было замечено, что скорость клубочковой фильтрации (СКФ) ниже, когда ВБД выше. Клубочковая фильтрация оценивается по формуле СКФ = САД – (2 х ВБД). Поэтому СКФ больше зависит от ВБД, чем от САД, и почки уязвимы при ИАГ [8]. Возможными механизмами развития почечной недостаточности являются повышение резистентности почечных сосудов, компрессия почечных вен, повышение уровня антидиуретического гормона, ренина и альдостерона и уменьшение СВ [8]. Тем не менее ухудшение почечной функции при ИАГ является локальным явлением, которое развивается в результате прямой почечной компрессии и не зависит исключительно от СВ. Восстановление функции почек возможно в результате декомпрессии [8].
К концу беременности почки могут сдвигаться растущей маткой вверх и назад [18]. Снижение почечного кровотока активирует РАС с увеличением уровня ренина и ангиотензина II (ATII). ATII вызывает такие симптомы преэклампсии как гипертония, вазоспазм и задержка жидкости [6,9,20,30]. На этом этапе мы замечаем увеличение уровня растворимой fms-подобной тирозинкиназы -1 (sFlt-1) и уменьшение сосудистого эндотелиального фактора роста (VEGF) и плацентарного фактора роста (PIGF), что ассоциируется с дисфункцией эндотелиальных клеток [7,19]. Дальнейшее исследование факторов ангиогенеза может выяснить их роль в патогенезе ИАГ.
Исследования показали, что длительная интраабдоминальная гипертензия приводит к повышению артериального давления, но не сопровождается изменением уровня ренина в плазме [5]. Возможно, в условиях постоянной интраабдоминальной компрессии саморегуляция РАС происходит по механизму отрицательной обратной связи, которой противодействуют факторы, активирующие ренин и ATII [21]. Именно поэтому ИАГ не рассматривалась как ведущая причина преэклампсии в течение длительного времени [28]. Дополнительные доказательства появились в поддержку дисрегуляции РАС в теории ИАГ [9,11,16]. В физиологическом течении беременности увеличивается концентрация ATII, что ведет к подъему артериального давления, в результате снижается секреция ренина почками с постепенной нормализацией артериального давления, и уровня АТII. При хронической интраабдоминальной компрессии непрерывное увеличение артериального давления вызывает уменьшение уровня ренина в плазме, приближаясь к уровню здоровых небеременных женщин. В то же время уровень ренина плазмы увеличивается. Как было обнаружено, что происходит из-за гиперактивности рецептора ангиотензина I. Это объясняет, почему в экспериментах острой компрессии почечных вен уровень ренина в плазме возрастает, а при непрерывной интраабдоминальной компрессии повышения уровня ренина не наблюдается. [28]
Другие гормоны могут играть определенную роль. Эстрогены способны активировать РАС [21]. Прогестерон обладает антиминералокортикойдной активностью и является антагонистом альдостерона. Одновременно с высоким уровнем прогестерона во время беременности активность ренина и уровень альдостерона в крови увеличены, чтобы компенсировать и предотвратить потерю натрия [21].
Нарушение почечной гемодинамики в результате ИАГ характеризуется повышением РПП, почечного венозного давления (ПВД), артериальной вазоконстрикцией, нарушением микроциркуляции, уменьшением почечной перфузии в результате снижения клубочковой фильтрации и почечной недостаточностью [9,11,16,20].
Снижение кровотока в ткани почки с последующим ишемическим воспалительным повреждением и есть морфологическая база кардиоренального синдрома (CRS) [26]. Увеличение центрального венозного давления, снижение почечной перфузии, внутриренальная гипертония, дисфункция эндотелия, активация провоспалительной и нейрогуморальной систем, оксидативный стресс рассматриваются в качестве основных механизмов, способствующих формированию кардиоренального синдрома. Гемодинамические изменения при кардиоренальном синдроме имеют много общего с теми, которые наблюдаются при преэклампсии.
Ronco и др. предложили несколько типов CRS (I–V). Преэклампсия может рассматриваться как вариант CRS (вторичный CRS, тип V) [26]. Нарушения гемодинамики печени из-за интраабдоминальной компрессии являются важным фактором в развитии печеночной недостаточности. Преэклампсия может рассматриваться в континууме кардиоренального и гепаторенального нарушений [26].
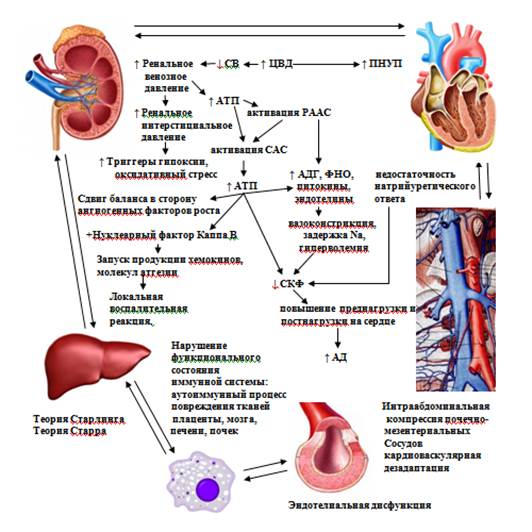
Рис. 3. Патофизиологические механизмы синдрома ИАГ, кардиоренального и гепаторенального континуума и их значение в развитии преэклампсии
СВ – сердечный выброс, АТII – ангиотензин II, ЦВД – центральное венозное давление, СКФ – скорость клубочковой фильтрации, ПНУП – предсердный натрийуретический пептид, ФНО – фактор некроза опухолей, АДГ – антидиуретический гормон.
Преэклампсия как проявление кардиоваскулярной дезадаптации
Беременность, как правило, характеризуется физиологической активацией РАС, что способствует увеличению объема плазмы крови [1,11,12,16,30]. Адаптивные изменения венозного кровообращения включают увеличение растяжения и эластичности венозных стенок [23]. Во время беременности отмечается повышение сердечного выброса, в регуляции которого важную роль играют венозный возврат, емкость и реактивность венозных сосудов, степень растяжения левого предсердия [9]. Адаптивные изменения при физиологической беременности включают увеличение объема циркулирующей крови, минутного объема крови, венозного давления и венозной емкости, а также изменения в системе гемостаза и микроциркуляции [9].
В 4–8 недель беременности сердечный выброс увеличивается на 15 %, и не более чем на 40 % во второй половине беременности. Уже в первом триместре наблюдается увеличение объема циркулирующей крови (ОЦК) и темпы ликвидации крови от сердца. Общее сопротивление сосудов уменьшается. Венозное русло вмещает 65–67 % циркулирующей крови, из которых 25 % ОЦК находятся в брюшной полости и печеночных венах. Уже в первом триместре отмечается расширение левого предсердия в результате увеличения синтеза предсердного натрийуретического пептида (ANP), противодействующего РАС [1,22,23].
Ganzevoort соавт. предложили рассматривать преэклампсию как синдром кардиоваскулярной дезадаптации (CVM) [11]. CVM характеризуется венозной дезадаптацией (уменьшение венозного возврата, емкости, реактивности венозных сосудов, эластичности и растяжения венозной стенки), гиповолемией, недостаточным увеличением CВ, меньшей, чем нормальная предсердной дилатацией и снижением синтеза ANP. Недостаточное увеличение CВ с последующим развитием раннего начала преэклампсии у беременных женщин отмечается уже в первом триместре беременности [9]. Гиповолемия и венозная дезадаптация сохраняются во время беременности. Почти у половины женщин с историей преэклампсии в течение 3-х месяцев после родов сохраняется гиповолемия и венозная дезадаптация, и такие женщины остаются в группе высокого риска для рецидивирующей преэклампсии в последующей беременности [16].
У беременных женщин с ранним началом преэклампсии регистрировалось недостаточное увеличение СВ в первом триместре. У женщин с поздним началом преэклампсии СВ был выше, по сравнению с физиологическим течением беременности [31]. Мы не нашли данные, объясняющие различия CВ при раннем и позднем начале гестоза. Однако, как ни вариацией ВБД можно объяснить различия CВ в ранних сроках беременности у женщин, у которых впоследствии развивается раннее или позднее начало преэклампсии. Вполне возможно, что при позднем начале преэклампсии уровень ВБД повышается, но не превышает 10 мм рт. ст., в то время как при раннем начале преэклампсии уровень ВБД превышает 10 мм рт. ст. на ранних сроках беременности.
Особенности Допплерометрии при преэклампсии
Если рассматривать преэклампсию как разновидность АКС, было бы логично оценить ВБД непосредственно. Существуют прямые (в лапаротомии, при перитонеальном диализе) и непрямые (измерения давления в мочевом пузыре, в желудке, в матке и в прямой кишке) методы оценки ВБД. Наиболее распространенным методом оценки ВБД является измерение давления в мочевом пузыре после его катетеризации и введении 25 мл 0,9 % раствора NaCl. Однако ни один из этих методов не может широко использоваться во время беременности. Во время кесарева сечения может быть выполнена интраоперационная оценка ВБД [2].
Доплерометрическое исследование вен может быть полезным, учитывая, что имеет место венозный стаз органов малого таза, печени, почек и артерио-венозное юкстамедуллярное шунтирование в почках. Безопасные, неинвазивные ультразвуковые методы являются предпочтительными во время беременности [3,4,13-15,17,22-24].
Качественный и количественный анализ допплеровской кривой кровотока в почечных и печеночных венах
Почки
Анализ спектральной допплеровской кривой проводят, учитывая качественные и количественные показатели.
Выделяют двухфазную, монофазную и плоскую форму КСК в междолевых почечных венах. Полное отсутствие фазности допплеровской кривой, соответствующей фазам систолы и диастолы, а также отсутствие синхронизации с дыханием являются признаками патологии [17]. У беременных монофазная форма КСК в междолевых почечных венах является показателем обструктивной уропатии и окклюзии почечной вены [3,14,17].
Оценка спектральной допплеровской кривой венозного кровотока позволяет определить максимальную и минимальную скорости кровотока.
Один из проверенных параметров почечной вены индекс резистентности междолевых почечных вен (RIVI) определяется по формуле:. RIVI = Vmax - Vmin / макс, где Vmax максимальна скорость кровотока, Vmin – минимальная скорость кровотока в междолевых почечных венах. Vmin и Vmax зависят как от СВ, так и от СКФ [4,13]. У женщин с физиологическим течением беременности в первом триместре отмечается снижение RIVI, в сравнении со здоровыми небеременными женщинами. В конце второго триместра RIVI правой почки на 15 % ниже, чем слева, что обусловлено компрессией беременной маткой и физиологической пиелоэктазией. RIVI уменьшается одинаково справа и слева до 30-й недели беременности, после 30-й недели снижается больше справа [13].
Некоторые авторы предлагают использовать RIVI как допплеровский знак ИАГ и КВД. У женщин, чья беременность осложнялась ранним началом преэклампсии, по сравнению с беременными с поздним началом преэклампсии и женщинами с физиологическим течением беременности, отмечалось увеличение RIVI. Допплерометрические маркеры интраабдоминальной компрессии были информативны за несколько недель до развития клиники рано начавшейся преэклампсии. В то же время оценка индекса резистентности (RI) не показали достоверных различий в наблюдаемых группах пациентов [13].
Печень
В связи с отсутствием клапанов в нижней полой вене форма кривой скоростей кровотока (КСК) в печеночных венах (HV) отражает кардиальный цикл правого предсердия. Выделяют трехфазную, двухфазную и плоскую форму КСК в HV [15].
При нормально протекающей беременности встречаются трех-, двухфазные и плоские формы КСК в печеночных венах. В I триместре чаще выявляется трехфазная форма КСК, во II триместре – двухфазная и / или плоская форма КСК. В III триместре в норме могут быть зафиксированы все варианты: трех-, двухфазные и плоские формы КСК [14].
Форма КСК в печеночных венах зависит от экстрагенитальной патологии, срока гестации, анатомических особенностей сосудов (наличия анастомозов). Монофазная форма КСК встречается при заболеваниях сердца (кардиомиопатии, легочная гипертензия, трикуспидальная регургитация), печени (печеночный стеатоз, цирроз, интраабдоминальная компрессия, тромбоз печеночных вен [24].
Некоторые исследователи отметили, что пиковая скорость зубца А на сроках гестации 30 и 37 недель достоверно ниже у женщин, беременность которых осложнилась ранней ПЭ, по сравнению с соответствующими показателями беременных с поздней ПЭ и женщин с физиологически протекающей беременностью. При этом достоверной разницы пиковых скоростей зубцов В, V, С в исследуемых группах пациенток выявлено не было [15].
Выводы
ПЭ является следствием дезадаптации организма к развивающейся беременности в результате неблагоприятного влияния многих факторов, где большую роль играет интраабдоминальная компрессия, приводящая в конечном итоге к полиорганной недостаточности.
Ультразвуковое допплерометрическое исследование печеночных и почечных вен дает ценную информацию о функционировании и адаптации венозной гемодинамики при беременности. Допплерометрические маркеры имеют прогностическое значение и появляются за несколько недель до клинических проявлений ранней преэклампсии.
Сокращения
ИАГ: интраабдоминальная гипертензия; КВД: кардиоваскулярная дезадаптация; АКС: абдоминальный компартмент синдром; АПД: абдоминальное перфузионное давление; ВБД: внутрибрюшное давление; САД: среднее артериальное давление; СКФ: скорость клубочковой фильтрации; CВ: сердечный выброс; РАС: ренин-ангиотензиновая система; РПП: почечное перфузионное давление; ATII: ангиотензин II; sFlt-1: fms-подобная тирозинкиназа -1; VEGF: сосудистый эндотелиальный фактор роста; PIGF: плацентарный фактор роста; ПВД: почечное венозное давление; ОЦК: объем циркулирующей крови; ПНУП: предсердный натрийуретический пептид; RIVI: индекс резистентности междолевых почечных вен.
Рецензенты:
Антонеева И.И., д.м.н., заведующая гинекологическим отделением МУЗ «Ульяновский областной онкологический диспансер», г. Ульяновск;
Кан Н.И., д.м.н., профессор, заведующая кафедрой последипломного образования и семейной медицины ФГБОУ ВПО «Ульяновский государственный университет», г. Ульяновск.



