Материалы и методы исследования
В работе использовалась фармацевтическая субстанция триазавирина (ООО "Завод Медсинтез", Россия, соответствующая ФС 000279-141211), стандартный образец фармацевтической субстанции триазавирина (ООО "Завод Медсинтез", Россия, соответствующий требованиям ФС Триазавирин стандартный образец), морская соль («Биотек Марин», Франция: СТП 00480201-363-2012,), вода очищенная.
Количественное определение триазавирина в фармацевтической композиции проводилось с использованием метода ВЭЖХ. Анализ выполнялся на жидкостном хроматографе Flexar F 15 (Перкин Элмер) с УФ детектором. В качестве неподвижной фазы служила хроматографическая колонка «Hydrosphere C18» компании YMC (Япония), 250 мм × 4,6 мм, размер частиц 3 мкм. Подвижная фаза: 10% ацетонитрила – 90% 0,025М водного раствора натрия ацетата тригидрата, рН = 7,40. Скорость потока 0,85 мл/мин. Детектирование осуществляли при длине волны 215 нм. Температура колонки 35±1 0С. Время проведения анализа 20 минут.
Методика. Исследуемый раствор: 2,5 мл исследуемого раствора помещали в мерную колбу вместимостью 25 мл, обрабатывали смесью ацетонитрил - 0,025М водного раствора натрия ацетата тригидрата (10:90), перемешивали в течение 10 минут, доводили до метки подвижной фазой.
Точную навеску стандартного образца триазавирина около 25 мг высушенного до постоянной массы, помещали в мерную колбу вместимостью 25 мл, растворяли в растворе подвижной фазы, перемешивали и доводили до метки растворителем.
Результаты исследования и их обсуждение
Для проведения исследования по количественному определению триазавирина была приготовлена модельная смесь состава: триазавирин 0,2508 г., морская соль 0,2506 г., вода очищенная до 25 мл.
На первом этапе исследования с целью разработки методики количественного определения представляло интерес подобрать оптимальную подвижную фазу (элюент) и условия хроматографирования. При подборе подвижной фазы учитывалась растворимость триазавирина в органических растворителях. Было установлено, что фармацевтическая субстанция триазавирина растворима диметилсульфоксиде, диметилформамиде, ацетонитриле и других органических растворителях. Наличие разнообразных групп (нитрогруппы, азогруппы, метилтиогруппы) в химической структуре триазавирина (рис.1) делает возможным применение метода ВЭЖХ в количественном анализе.
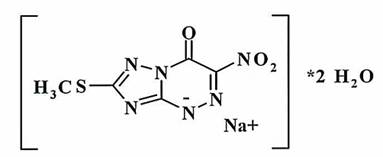
Рис. 1. Химическая структура триазавирина
В результате анализа литературных источников [5] было установлено, что наиболее часто в методе ВЭЖХ в качестве подвижной фазы используется ацетонитрил. Данный элюент находит широкое применение при анализе лекарственных препаратов. Кроме того, ацетонитрил обладает достаточно высокой элюирующей силой, относительно незначительным токсическим действием, низкой вязкостью и доступностью. Было установлено, что триазавирин растворим в ацетонитриле. Также было установлено, что наиболее часто при анализе лекарственных препаратов, являющихся солями сильных оснований, используется сочетание ацетонитрила с 0,025М водным раствором натрия ацетата. Поэтому выбор был сделан в пользу данной подвижной фазы. Следующим этапом был подбор оптимального соотношения ацетонитрила и 0,025М водного раствора натрия ацетата тригидрата. С этой целью были приготовлены растворы, содержащие различное соотношение ацетонитрила и 0,025М водного раствора натрия ацетатата тригидрата (табл. 1).
Таблица 1
Соотношение компонентов в составе подвижной фазы
|
№ подвижной фазы |
Компоненты подвижной фазы |
|
|
Ацетонитрил, % |
0,025М водного раствора натрия ацетата тригидрата, % |
|
|
1 |
5 |
95 |
|
2 |
10 |
90 |
|
3 |
15 |
85 |
|
4 |
20 |
80 |
|
5 |
25 |
75 |
|
6 |
30 |
70 |
Было установлено, что наиболее оптимальное время хроматографирования, значения эффективности и разрешения между пиками триазавирина и его основной примеси 3-метилтио--5-амино-1,2,4-триазола получались при соотношении ацетонитрила и 0,025М водного раствора натрия ацтетата тригидрата (10:90), поэтому был сделан выбор в пользу данного соотношения этих компонентов подвижной фазы.
На следующем этапе была разработана оптимальная методика количественного определения триазавирина в фармацевтической композиции. Методика приготовления исследуемого и стандартного растворов для хроматографирования представлена в разделе «Материалы и методы исследования».
Для анализа 10 мкл испытуемого раствора и 10 мкл раствора стандартного образца субстанции триазавирина попеременно вводили в колонку хроматографа при помощи автосамплера.
На рисунке 2 представлена хроматограмма исследуемого раствора.
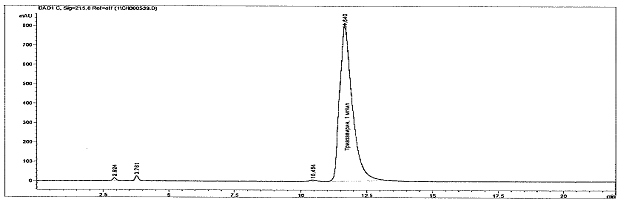
Рис. 2. Хроматограмма исследуемого раствора
Из представленной на рис. 2 хроматограммы видно, что время удерживания триазавирина при анализе исследуемой модельной смеси составило 11,0±0,5 минут, для стандартного образца триазавирина время удерживания составило 11,1±0,5 минут. Время удерживания исследуемого вещества, находящегося в испытуемом растворе, не значительно отличается от времени удерживания стандартного образца триазавирина. Относительное стандартное отклонение времени удерживания не превышает 0,5%.
Содержание триазавирина в мг в 1 мл исследуемого раствора вычисляли по формуле:
Xмг/мл=![]() ,где
,где
S1 – среднее значение площади пика триазавирина на хроматограмме испытуемого раствора, полученное из трех определений;
S0 – среднее значение площади пика триазавирина на хроматограмме раствора стандартного образца, полученное из трех определений;
a0 – навеска стандартного образца субстанции триазавирина, мг;
Р –содержание триазавирина в стандартном образце, %;
2,5; 25; и 25 показатели разведения;
Проверку пригодности хроматографической колонки проводили по следующей методике: 25 мг (точная навеска) СО триазавирина помещали в мерную колбу вместимостью 25 мл., растворяли в растворе подвижной фазы, добавляли 0,25 мл раствора стандартного образца 3 метилтио-5-амино-1,2,4-триазола, перемешивали и доводили до метки растворителем.
Приготовление стандартного образца 3 метилтио-5-амино-1,2,4-триазола: 25 мг (точная навеска) 3 метилтио-5-амино-1,2,4-триазола помещали в мерную колбу вместимостью 25 мл., растворяли в растворе подвижной фазы, доводили до метки тем же растворителем.
С целью проверки пригодности хроматографической системы проводили 5 кратное хроматографирование 10 мкл раствора. В дальнейшем рассчитывали следующие показатели: эффективность колонки, разрешение между пиками, фактор асимметрии. В результате расчетов были получены следующие данные (таблица 2).
Таблица 2
Результаты определения пригодности хроматографической колонки
|
Наименование параметра хроматографической колонки |
Формула расчета |
Полученные значения параметра |
Нормативный показатель для включения в нормативную документацию
|
|
Эффективность колонки для пика триазавирина |
N = 5,54×RT2 / W20,5 , где: RT – время удержания пика; W0,5 – ширина пика на 0,5 высоты |
3524 |
Не менее 3500 теоретических тарелок |
|
Разрешение между пиками триазавирина и 3 метилтио-5-амино-1,2,4-триазола |
Rs = (2×(t’R2 - t’R1))/(W2+W1), где t’R1, t’R2 – приведенные времена удерживания образцовых компонентов*; W1, W2 – ширина пиков образцовых при основании |
5,12 |
Не менее 5 |
|
Фактор ассиметрии триазавирина на высоте 5% от основания |
Т = W0,05/2а, где W0,05 – ширина пика на высоте 5%; a – расстояние от фронта пика до высоты, измеренное на высоте 5% от основания |
1,3 |
Не более 1,5 |
*время удерживания триазавирина составило 11,640 минут, время удерживания 3 метилтио-5-амино-1,2,4-триазола составило 0,46 минут
Результаты, полученные при хроматографировании, позволяют оценить пригодность данной хроматографической системы, а также сделать заключение о том, что данная система может быть использована для анализа триазавирина в составе фармацевтической композиции для назального применения.
Следующим этапом исследования была валидация методики количественного определения триазавирина в фармацевтической композиции.
Валидация представляет собой процесс экспериментального подтверждения того, что методика, используемая для анализа, обеспечивает получение необходимой и достоверной информации об исследуемом веществе, а также может быть пригодна для практического применения [6].
Валидация методики осуществлялась по таким валидационным характеристикам как линейность, прецизионность в условиях повторяемости и базировалась на данных литературных источников [5,6].
Линейность аналитической методики, по данным литературных источников [6], представляет собой наличие линейной зависимости аналитического сигнала (в нашем случае площадь пика триазавирина) от концентрации определяемого вещества в исследуемой пробе в пределах аналитической области методики.
С целью проведения валидации методики по характеристике линейность готовили растворы стандартных веществ из фармацевтической субстанции триазавирина 5 уровней концентрации 10, 50, 75, 100, 125 и 150% от номинального значения с постоянным содержанием в них морской соли (10 мг/мл). Затем проводили разведение, согласно описанной выше методики и хроматографировали полученные пробы. Далее проводили измерение аналитического сигнала, в качестве которого выступала площадь пика для анализируемых проб. Оценку линейности проводили путем расчета коэффициента корреляции (значение должно быть не менее 0,999). Результаты анализа представлены в таблице 3.
Таблица 3
Результаты определения триазавирина в фармацевтической композиции (оценка линейности)
|
Навеска триазавирина, г |
Концентрация раствора, мг/мл |
Площадь пика |
|
0,0256 |
0,0256 |
1820822 |
|
0,1253 |
0,1253 |
9057475 |
|
0,1874 |
0,1874 |
13118000 |
|
0,2510 |
0,2510 |
18114951 |
|
0,3125 |
0,3125 |
21903822 |
|
0,3752 |
0,3752 |
2651700 |
На основании полученных данных была построен график зависимости площади пика от концентрации триазавирина (рис.3).
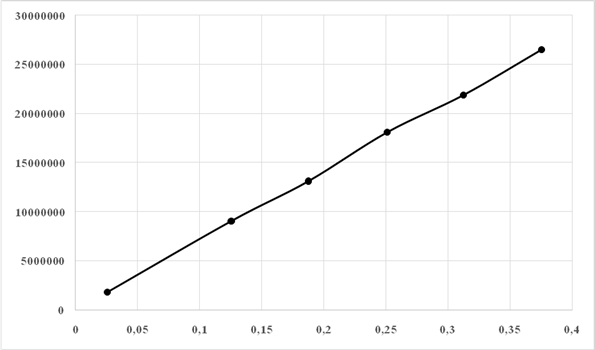
Рис. 3. График зависимости площади пика (по оси ординат) от концентрации триазавирина (по оси абсцисс)
Из рисунка 3 видно, что наблюдается линейная зависимость площади пика от концентрации триазавирина (y =7×107 +100409; r = 0,9995) в диапазоне концентраций от 10 до 150% от номинального значения, т.е. в интервале от 0,02 до 0,4 мг/мл. Коэффициент корреляции равен 0,9995, что соответствует рекомендуемым значениям (не менее 0,999).
На следующем этапе оценивалась прецизионность методики в условиях повторяемости.
Повторяемость – это первый уровень прецизионности. Оценка методики количественного определения проводится по независимым результатам, получаемых в одинаковых условиях в одной лаборатории (одним и тем же аналитиком, на одном и том же оборудовании, с использованием одного и того же набора реактивов) в пределах короткого промежутка времени [6].
Определение показателя прецизионность методики в условиях повторяемости проводили на одном исследуемом образце (состав: триазавирин 0,2508 г., морская соль 0,2506 г., вода очищенная до 25 мл.). Определение было проведено 6 кратно, количественное концентрацию триазавирина в растворе определяли по градуировочному графику с учетом разведения. Затем рассчитывали относительное стандартное отклонение. Результаты определения прецизионности в условиях повторяемости для триазавирина представлены в таблице 4.
Таблица 4
Результаты определения прецизионности в условиях повторяемости для триазавирина
|
№ |
Площадь пика триазавирина |
Найденная концентрация триазавирина, мг/мл |
|
1 |
17792909 |
10,11 |
|
2 |
17704912 |
10,06 |
|
3 |
17968902 |
10,21 |
|
4 |
18114951 |
10,29 |
|
5 |
18440409 |
10,48 |
|
6 |
18580409 |
10,56 |
|
|
- |
10,246 |
|
SD |
- |
0,2003 |
|
RSD,% |
- |
1,95 |
Расчет показал, что относительное стандартное отклонение составило 1,95%. Полученные данные говорят о том, что методика обладает достаточно хорошей прецизионность в условиях повторяемости.
Заключение
Разработанная методика количественного определения триазавирина в фармацевтической композиции для назального применения с использованием метода ВЭЖХ показала хорошие результаты, следовательно, может быть использована в количественном анализе с последующим включением ее в нормативную документацию на ЛФ.
Рецензенты:Русинов В.Л., д.х.н., профессор директор химико-технологического института Уральского федерального университета им. Первого Президента России Б.Н. Ельцина, г.Екатеринбург;
Денисенко О.Н., д.фарм.н., профессор, декан ФУП, заведующий кафедрой фармации Пятигорского МФИ филиала ГБОУ ВПО Волгоградский ГМУ Минздрава России, г. Пятигорск.



