Цель исследования.Ранее нами показано, что феноксициклопропан в условиях нитрозирования аналогично арил- и аралкилциклопропанам также трансформируется в гетероциклическую систему изоксазолинового ряда [3]. Представлялось интересным изучить взаимодействие галогензамещенных производных феноксициклопропана в условиях реакции нитрозирования и изучить конкурирующее влияние малого цикла и заместителей в феноксипроизводных на примере циклопропилметилфенилового эфира (I) и 2-циклопропилфеноксиаллила (II).
Установлено, что взаимодействие исследуемых соединений протекает не региоселективно. Синтезированные соединения (I) и (II) в реакции с азотистой кислотой, образующейся insitu, подвергались преимущественному раскрытию малого цикла с образованием ожидаемых гетероциклических структур (IV-VIII).
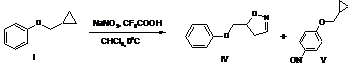
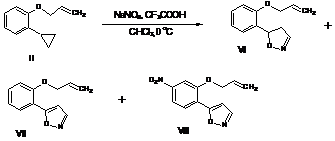
Схема 1
В среде трифторуксусной кислоты в отсутствии нитрита натрия, а также в уксусной кислоте, как без нитрита натрия, так и в его присутствии, указанные соединения возвращаются неизмененными.
Экспериментальная часть
Спектры ЯМР 1Н и 13Cрегистрировали на спектрометре «Varian BXR-400» в CDCl3. В качестве внутреннего стандарта использовали остаточный сигнал CHCl3(δ 7.25, м.д). ИК спектры записывали на спектрофотометре UR-20 в интервале 400-3600 см-1в вазелиновом масле.Масс-спектры получали на приборе Finnigan SSQ 7000 (типа GC-MS) с использованием капиллярной колонки (30 м х 2 мм, неподвижная фаза DВ-1), газ-носитель – гелий (40 мл/мин) и программированием температуры от 50до 300°С (10 град/мин). Энергия ионизации 70 эВ. Разделение реакционных смесей и контроль чистоты продуктов реакции проводили на колонках или на пластинах в тонком слое, носитель – силикагель L40/100 мкм (Чехия), используя элюент – диэтиловый эфир-петролейный эфир (40-70°С), 1:3 (по объему).
Циклопропилметилфениловый эфир (I) получали восстановлением 2,2-дихлорциклопропилметилфенилового эфира (III) по методике [4]. 2-Циклопропилфеноксиаллил (II) получали по методике [5].
Циклопропилметилфениловый эфир (I).Выход 83%. Т.кип. 103-105оС (20 мм рт.ст.),(51-53оС (2 мм рт.ст.), ![]() 1.5199). Спектр ЯМР 1Н (CDCI3), δ, м.д.: 0.38-0.40 м (2H), 0.69-0.71 м (2H, СН2), 1.32-1.34 м (1Н, СН), 3.84 д (2Н, J 6.0 Гц),6.96-7.01 м (3Hаром), 7.31-7.36м (2Hаром) Спектр ЯМР 13C (CDCI3), δ, м.д.: 3.23, 10.36, 72.66, 114.62, 120.64, 129.47,159.05.[M]+ 148. Найдено, %: С 80.91; Н 8.31. С10Н12O. Вычислено, %: С 81.04; Н 8.16.
1.5199). Спектр ЯМР 1Н (CDCI3), δ, м.д.: 0.38-0.40 м (2H), 0.69-0.71 м (2H, СН2), 1.32-1.34 м (1Н, СН), 3.84 д (2Н, J 6.0 Гц),6.96-7.01 м (3Hаром), 7.31-7.36м (2Hаром) Спектр ЯМР 13C (CDCI3), δ, м.д.: 3.23, 10.36, 72.66, 114.62, 120.64, 129.47,159.05.[M]+ 148. Найдено, %: С 80.91; Н 8.31. С10Н12O. Вычислено, %: С 81.04; Н 8.16.
2-Циклопропилфеноксиаллил (II). Выход 87%. Т.кип.139оС (20 мм рт.ст.), ![]() 1.5376 (117-119оС (8 мм рт.ст.),
1.5376 (117-119оС (8 мм рт.ст.), ![]() 1.5381). Спектр ЯМР 1Н (CDCI3), δ, м.д.: 0.72-0.76 м (2H), 0.98-1.02 м (2H, СН2), 2.28-2.35 м (1Н, СН), 4.65 д (2H,J 6.0 Гц), 5.34 д (1H,J 6.0 Гц), 5.55 д (1H,J 6.0 Гц), 6.12-6.21 м (2Hаром.), 6.89-6.95 м (2Hаром.). 7.16-7.19 м (2H). [M]+ 174.
1.5381). Спектр ЯМР 1Н (CDCI3), δ, м.д.: 0.72-0.76 м (2H), 0.98-1.02 м (2H, СН2), 2.28-2.35 м (1Н, СН), 4.65 д (2H,J 6.0 Гц), 5.34 д (1H,J 6.0 Гц), 5.55 д (1H,J 6.0 Гц), 6.12-6.21 м (2Hаром.), 6.89-6.95 м (2Hаром.). 7.16-7.19 м (2H). [M]+ 174.
Взаимодействие соединений (I, II) с нитритом натрия в трифторуксусной кислоте. Общая методика. К раствору 10 ммоль соединения (I, II) в 5 мл трифторуксусной кислоты и 10 мл хлороформа прибавляли 10 ммоль нитрита натрия при температуре -10оС в течение 30 мин. Смесь перемешивали 30 мин, разбавляли 300 мл воды, экстрагировали 50 мл хлороформа. Органический слой промывали водой до достижения нейтральной среды и сушили MgSO4. Растворитель отгоняли, остаток хроматографировали на силикагеле.
В результате реакции из 1.48 г (10 ммоль) циклопропилметилфенилового эфира (I)получилициклопропилметил-4-нитрозофениловый эфир (IV). Выход 0.16 г (9%), жидкость бирюзового цвета; разлагающаяся при комнатной температуре и 0.30 г (17%) изоксазолина (V). Спектр ЯМР 1Н (CDCI3), δ, м.д.: 3.41-3.46 д.д (1H, СН2,2J 16.0, 3J 3.2 Гц), 3.87-3.92 д.д (1H, СН2, 2J16.0, 3J 9.6 Гц), 4.02 д (2Н, СН2, 3J 3.2 Гц), 6.73-6.75 д.д (1H, СН,3J 9.6, 3J 3.2 Гц), 6.97-7.41 м (5Hаром),7.53 уш.с (1H, NCH).Спектр ЯМР 13C (CDCI3), δ, м.д.: 14.70, 52.93, 66.97, 115.51, 121.01, 129.81, 155.30. Масс-спектр, m/z (Iотн, %): [M]+ 177 (8). Найдено, %: С 67.91; Н 6.34; N 8.11. С10Н11NO2. Вычислено, %: С 67.78; Н 6.26; N7.90.
В результате реакции из 1.74 г (10 ммоль) 2-циклопропилфеноксиаллила (II) по данным физико-химических методов исследования образуется изоксазолин (VI), вязкое масло.Выход 1.56 г (77%). Спектр ЯМР 1Н (CDCI3), δ, м.д.: 2.85-2.92, д.д.д (1H, СН2,3J1.3,3J 7.3,3J 17.7Гц), 3.43-3.51, д.д.д(1H, СН2,3J 1.3,3J 11.2,3J 17.5 Гц),4.58 д (2H, СН2,3J 5.3 Гц), 5.30д (1H, СН2,3J 10.4 Гц), 5.43д (1H, СН2,3J 17.2 Гц), 5.82д.д(1H, СН,3J7.6,3J 11.2 Гц), 6.05д.д.т (1H, СН,3J 5.3, 3J 10.4, 3J 17.2 Гц), 6.88 д (1H, СН,3J8.1, Гц), 6.97.т (1Hаром, J7.6 Гц), 7.18уш.с (N=CH), 7.27 т (1Н, 3J7.8), 7.41 д (1Н, 3J7.6). Спектр ЯМР 13C (CDCI3), δ, м.д.: 69.41, 114.55, 118.74, 124.63, 131.8, 163.93, 164.62. Масс-спектр, m/z (Iотн, %): [M]+ 203 (5), 131 (100), 121 (11), 107 (5), 91 (17), 77 (10), 65 (10), 63 (5), 41 (26). Найдено, %: С 70.86; Н 6.25; N6.94. С12Н13NO2. Вычислено, %: С 70.92; Н 6.45; N6.89.
При трехкратном избытке нитрита натрия образуется смесь:изоксазола (VII).Выход 1.23 г (61%). Спектр ЯМР 1Н (CDCI3), δ, м.д.: 4.68 д (2H, СН2,3J 5.3 Гц), 5.38д (1H, СН2,3J 10.4 Гц), 5.46д (1H, СН2,3J 17.2 Гц), 6.14 д.д.т (1H, СН,3J 5.3, 3J 10.4, 3J 17.2 Гц),6.85д(1H, СН, 3J 1.8 Гц), 7.02 д (1H, СН,3J8.6 Гц), 7.10 т (1Hаром, J7.7 Гц), 7.39 т (1Hаром, J7.7 Гц), 8.02 д (1Hаром, J7.8 Гц), 8.32д (1Н, 3J 1.8 Гц). Спектр ЯМР 13C (CDCI3), δ, м.д.: 69.41, 114.55, 118.74, 124.63, 131.8, 163.93, 164.62. Масс-спектр, m/z (Iотн, %): [M]+ 201 (85), 172 (25), 133 (42), 121 (51), 105 (35), 92 (18), 77 (46), 63 (19), 51 (20), 41 (100). Найдено, %: С 71.83; Н 5.73; N 6.89. С12Н11NO2. Вычислено, %: С 71.63; Н 5.51; N 6.96 и нитрозамещенногоизоксазола (VIII). Выход 0.83 г (34%), блед. желтые кристаллы, т.пл. 93-95оС (гексан).ИК спектр, ν, см-1: 1550, 1335 (NO2).Спектр ЯМР 1Н (CDCI3), δ, м.д.: 4.83 д (2H, СН2,3J 5.5 Гц), 5.44 д (1H, СН2,3J 10.6 Гц), 5.53 д (1H, СН2,3J 17.2 Гц), 6.19 д.д.т (1H, СН,3J 5.5, 3J 10.6, 3J 17.2 Гц), 6.89д (1Н, 3J 1.6 Гц), 7.11 д (1Hаром, J 9.2 Гц), 8.30д.д (1Hаром, 3J 9.2,4J 2.8 Гц), 8.36 с (1Н), 8.89 д (1Н, 4J 2.8 Гц). Спектр ЯМР 13C (CDCI3), δ, м.д.: 70.42, 104.20, 110.89, 112.36, 117.08, 120.05, 123.84, 126.45, 131.16, 151.11, 159.34, 163.01. Масс-спектр, m/z (Iотн, %): [M]+ 246. Найдено, %: С 58.46; Н 4.12; N11.44. С12Н10N2O4. Вычислено, %: С 58.54; Н 4.09; N 11.38.
Заключение.Нами былисинтезированы циклопропилметилфениловый эфир (I) и 2-циклопропилфеноксиаллил IIи изучено влияние малого цикла и заместителей в реакции нитрозирования. Показано, что данные соединения претерпевают преимущественную трансформацию малого цикла в изоксазолиновый фрагмент, наряду с незначительным электрофильнымнитрозированием в ароматическое кольцо. Полученные соединения анализировались на ростостимулирующую активность. В системе лабораторного скрининга проведены исследования возможного влияния синтезированных соединений на прорастание семян масличных и зерновых культур. Оценивалось всхожесть семян, особенности ростовых и синтетических процессов в проростках. С этой целью контрольные семена (обработанные водой) и опытные, обработанные препаратом, раскладывали в чашки Петри и проращивали при комнатной температуре (20-22оС). Показано, что пределы оптимальных концентраций, обладающих выраженной ростостимулирующей активностью составляют 0,01–0,001 мас.%. Результаты исследований определяют широкие возможности и перспективность дальнейшего изучения наших соединений в данном направлении.
Работа выполнена при финансовой поддержке научных исследований в Республике Северная Осетия-Алания (проект 15 рк-3-2014).
Рецензенты:
КалаговаР.В., д.х.н., профессор, зав. кафедрой химии и физики ГБОУ ВПО СОГМА Минздрава России, г. Владикавказ;
ЧерчесоваС.К., д.б.н., декан биолого-технологического факультета, ФГБОУ ВПО «Северо-Осетинской государственный университет», г. Владикавказ.



