Промышленные сточные воды и отработанные отвальные руды горно-обогатительных предприятий содержат простые и комплексные цианиды, ионы мышьяка и тяжелых металлов, которые являются сильными ядами. Наиболее перспективными для извлечения золота в этих условиях можно считать биотехнологические методы с использованием жизнедеятельности микроорганизмов [4,3].
Объекты и методы исследования
Изучение количественного и качественного состава микрофлоры месторождения Бакырчик проводили по общепринятым методикам. Пробы рудных вод при обследованиях отбирались стерильно, в соответствии с имеющимися руководствами. Подсчет количества микроорганизмов проводили методом предельных разведений испытуемых вод или болтушек на элективных средах в двух – трехкратных повторностях.
Для количественного учета A.ferrooxidans, содержащихся в 1 г использовали метод кратных разведений. При исследовании рудного субстрата навеску измельчали в гомогенизаторе и растирали в ступке и готовили исходную взвесь в разведении 1:10. Из полченной взвеси или исходного жидкого материала готовили ряд последующих разведений с таким расчетом чтобы при посеве двух последних разведений на чашке Петри агаре выросло от 50 до 300 колоний.
Получение накопительной культуры для выделения культуры в колбы Эрленмейра на 100мл вносили 30мл стерильной среды Сильвермана и Лундгрена 9К и пробы рудничной воды или руды из месторождений сульфидных руд, затем инкубируют при 30ºС до появления роста. О развитии бактерии судили по появлению бурой окраски среды, вызванной образованием соединении трехвалентного железа.
Для выделения культуру A.ferrooxidans в колбу Эрленмейера емкостью 250 мл вносили среду Сильвермана и Лундгрена 9К в объеме 150 мл. Затем добавляли пробы руды из месторождений сульфидных руд, инкубировали при 30ºС до появления роста. Для выделения штаммов бактерии, активных в окислении сульфидных минералов и устойчивых к ионам тяжелых металлов, использовали также сульфидные минералы.
Определение Fe+2 и Fe+3 проводилось объемным трилонометрическим методом в пробах, основанным на образовании комплекса трехвалентного железа с сульфосалициловой кислотой, который окрашивается в малиновый цвет. Содержание железа в растворах варьировало в диапазоне 0,1-10 г/дм3 [2].
Учет Th.thiooxidans вели по появлению неисчезающей мути и оседанию серы, по образованию пленки серы, подкислению среды и другим специфическим признакам на среде Ваксмана (г/л): (NH4)2SO4–3,0; КН2РО4–3,0; MgSO4·7H2O–0.5; CaCl2·6H2O–0.25; Fe2SO4·7H2O–3.0; серный цвет (Sº) – 10; H2O–1,0 л, рН 4,0, [1].
Для количественного учета аммонификаторов использовали пептонную воду (г/дм3 водопроводной воды): пептон – 10, NaCl – 0,5.
Для определения количества нитрификаторов I и II фазы была использована элективная минеральная среда Виноградского (г/л водопроводной воды): (NH4)2SO4 – 2,0; K2HPO4 – 1,0; MgSО4 – 0,5; FeSО4 – 0,4, NaCl – 2,0, в избыточном количестве CaCO3 [6, 7].
Для учета денитрифицирующих бактерий применяли элективную среду Гильтая (г/л водопроводной воды): цитрат натрия или калия трехзамещенный – 5,0, KNO3 – 2,0, аспарагин - 1,0, KH2PO4 – 2,0, MgSO4 – 2,0, CaCl2 – 0,2, FeCl3 – следы, агар – 18% [5].
Для подсчета азотфиксирующих бактерий производили высев 0,25 г пробу руды на среду Эшби. О наличии азотобактерий в исследуемом материале судили по образованию характерных колоний вокруг песчинок. Производили подсчет количества колоний на чашке в пересчете на 1 г руды.
Сапрофитные бактерии учитывали на мясопептонном агаре.
Результаты исследования и их обсуждение
Исходя из анализа имеющихся гидрохимических материалов, химический состав и качество вод изучаемой площади Бакырчикского золотоносного месторождения характеризуется следующими данными.
Сухой остаток трещинных вод изменяется по площади и глубинам опробования составлял 0,2-0,6 г/дм3, жесткость - 2,1 - 5,3 мг-экв/дм3, рН = 6,7 - 7,9. Химический состав вод гидрокарбонатный и гидрокарбонатно-сульфатный по анионам и кальциевый, кальциево-натриевый по катионам.
Содержание веществ группы азота (NO2, NO3, NH4) намного ниже нормативных уровней, перманганатная окисляемость по О2 низкая, концентрация железа не превышает 0,25 мг/дм3. Микроэлементы (Cu, Pb, Zn, As, F и др.) содержатся в количествах намного меньше допустимых пределов.
Тионовые бактерии A. ferrooxidans встречались в основном в воде, имеющей слабо кислую реакцию среды (рН 5,0 – 5,5). Наибольшее количество A. ferrooxidans было отмечено в пробах шахтной воды горизонта 170, численность варьировала в пределах 10 - 103 кл./мл воды, а также в рудничных водах горизонтов 210 и 290 с численностью до 102 кл./ мл воды (рисунок 1).
В водах горизонтов 90 и 330 тионовые бактерий не обнаружены, что видимо, связано с нейтральной реакцией шахтных вод и непродолжительным контактом руд с кислородом воздуха.
Распространение бактерий Тh.thiooxidans в природе зависит от наличия восстановленных соединений серы, используемых этими бактериями для хемоавтотрофного роста. Основная масса серы в природе связана с металлами в сульфатной и сульфидной форме, часть ее находится в виде самородных месторождений. Как известно, бактерий этой группы способны осуществлять процессы, приводящие к разрушению или образованию месторождений полезных ископаемых, минералов и горных пород, а также к миграции отдельных элементов. Изучение этих процессов важно для теоретических представлений о круговороте элементов, а также для добычи полезных ископаемых.
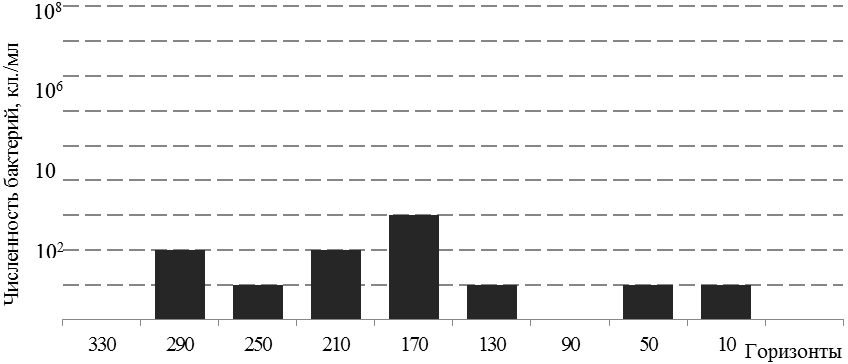
Рис. 1. Численность бактерий A. ferrooxidans в шахтных водах
При обследовании стоячих вод и капежей месторождения Th. thiooxidans были обнаружены в пробах воды, имеющих слабокислую реакцию (рН 5,0-5,5), численность достигала 10 - 102 кл./мл (рисунок 2). Было установлено, что температура рудного тела с увеличением глубины горизонта снижается c 12 до 6,5 ºС,, рН колеблется в пределах 5,5 - 7,5.
Таким образом, обнаружение тионовых бактерий в шахтных водах на различных горизонтах и характеристика экологических условий их жизнедеятельности дают основание считать, что на месторождении Бакырчик они выступают в качестве окислителей рудных минералов.
Анализируя данные о численности и характере распределения хемолитоавтотрофных бактерий A. ferrooxidans и Th. thiooxidans – основных показателей степени окислительно-востановительных процессов, необходимо отметить, что они встречались в шахтных водах редко и в незначительных количествах. С глубиной горизонта количество находок A. ferrooxidans значительно уменьшалось, распределение же Th. thiooxidans определялось наличием серы в нижних горизонтах шахтных вод. Ареалы распространения тионовых бактерий характеризуются слабокислой реакцией среды.
Присутствие тионовые бактерии в рудном теле отмечалось во всех типах слагающих пород. Численность A. ferrooxidans колебалась в пределах 10-103 кл./г руды. Наибольшее количество бактерий было приурочено к осадочным и углисто-глинистым породам. Численность Th. thiooxidans была выше - 102-103 кл./г руды. Вскрышная глинистая порода, серые песчаники, пепловые туфы и кремнистые образования содержали наибольшее количество этих бактерий (рисунок 3). Образцы пород с находками тионовых бактерий имели слабокислую реакцию.
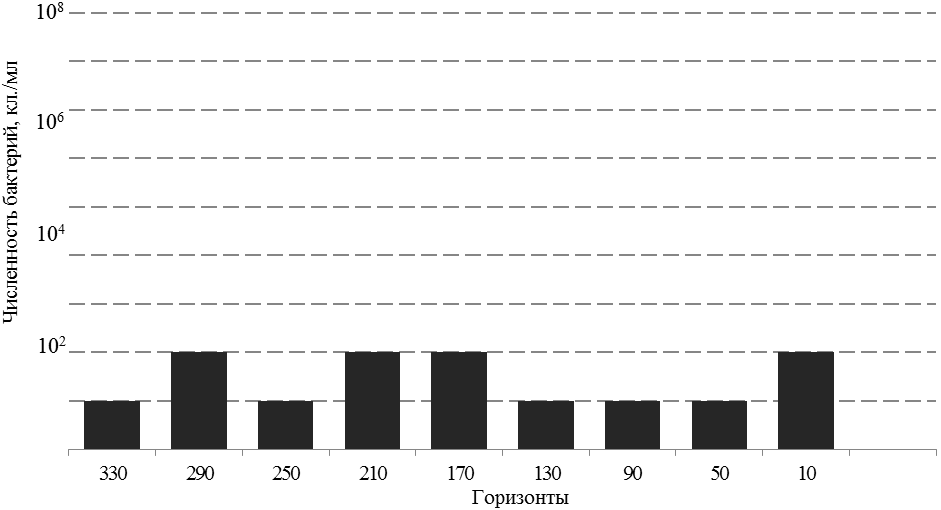
Рис. 2. Численность бактерий Тh. thiooxidans в шахтных водах
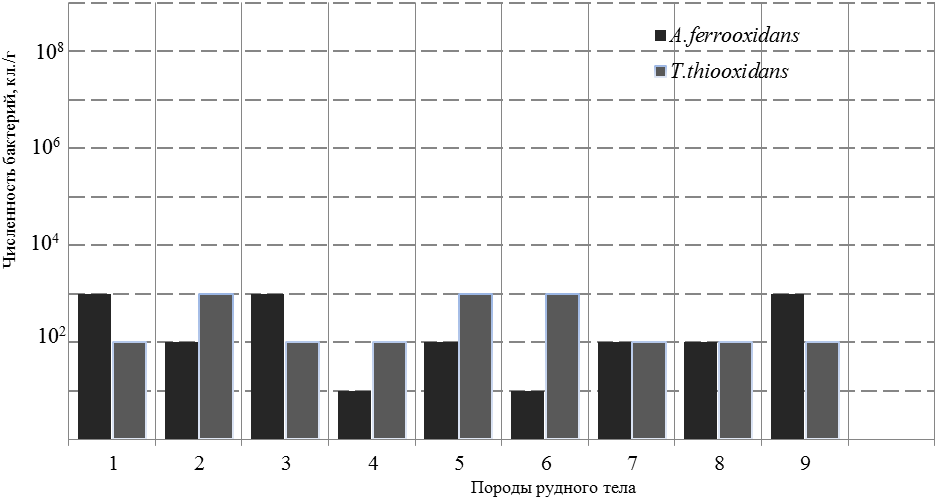
Рис. 3. Численность тионовых бактерий в рудном теле
Таким образом, распространение тионовых бактерий в отдельных породах рудного тела свидетельствует о процессах бактериального окисления серы и других рудных элементов. Если сравнить эти данные с расположением рудного тела и золотовмещающих минералов по горизонтам, то можно отметить, что бактериальные окислительные процессы идут как в верхних, так и в нижних горизонтах. Это, в свою очередь, подтверждает присутствие достаточного количества влаги и кислорода в исследованных породах, а также их способность адсорбировать бактериальные клетки.
Заключение
В результате выполненной работы были сделаны следующие выводы:
1. Из образцов шахтных вод и пород рудного тела с повышенным количеством тионовых бактерий были получены накопительные культуры, из которых выделено 6 чистых культур тионовых бактерий.
2. Предварительная идентификация выделенных бактерий по способности окислять закисное железо и соединения серы, а также аэробному автотрофному метаболизму позволила отнести их к виду Acidithiobacillus ferrooxidans.
Рецензенты:
Заядан Б.К., д.б.н., профессор, профессор кафедры «Биотехнология», КазНУ им. аль-Фараби, г. Алматы;
Мукашева Т.Д., д.б.н., профессор, профессор кафедры «Биотехнология», КазНУ им. аль-Фараби, г. Алматы.



