В последнее время большое внимание привлекают синтетические возможности новых электрофильных реагентов, дихлорида и дибромида селена [1-10], которые являются более селективными по сравнению с использующимися ранее тетрагалогенидами селена [10]. Например, реакции дихлорида и дибромида селена с ацетиленом протекают как стереоселективное анти-присоединение с образованием Е,Е-бис(2-галогенвинил)селенидов с выходами, близкими к количественным, в то время как присоединение к ацетилену тетрагалогенидов селена приводит, наряду с Е,Е-бис(2-галогенвинил)селенидами, к продуктам их галогенирования по одной двойной связи [10].
Присоединение дигалогенидов селена к двойной связи в большинстве случаев протекает региоселективно, причем значительное влияние на направление реакции может оказать природа заместителя при двойной связи. В реакциях дигалогенидов селена с дивинилсульфидом и дивинилселенидом образуются продукты присоединения по правилу Марковникова, 2,6-дигалоген-1,4-тиаселенаны и -диселенаны, которые претерпевают перегруппировку и превращаются в термодинамически более устойчивые 1,3-тиаселеноланы и -диселеноланы [1; 2; 6; 8]. В отличие от винилсульфидов двойная связь в винилсульфонах дезактивирована к электрофильному присоединению за счет сильного электроноакцепторного эффекта сульфонильной группы. В реакциях дигалогенидов селена с дивинилсульфоном, которые протекают медленнее, чем с дивинилсульфидом, селен присоединяется преимущественно в α-положение двойной связи с образованием 4- и 5-членных гетероциклов [9].
Влияние такой сильной электроноакцепторной группы, как карбонильная, приводит к образованию продуктов присоединения против правила Марковникова - это наблюдается в реакции дигалогенидов селена с метилвинилкетоном [4].
Материалы и методы исследования
Спектры ЯМР 1Н и 13С регистрировали на приборе Bruker DPX-400 (рабочие частоты 400.13, и 100.61 МГц соответственно) в CCl4, внутренний стандарт - ГМДС. Элементный анализ выполнен на приборе Thermo Finigan EA 1112.
Типичная методика. Синтез 2-хлор-3-фенилпропилтеллуртрихлорида (II). К смеси 0.54 г (2 ммоль) TeCl4 и 50 мл ССl4 прибавили раствор 0.24 г (2 ммоль) аллилбензола в 5 мл ССl4 и перемешивали смесь 60 часов при комнатной температуре. Отгоняли растворитель на роторном испарителе, остаток промыли холодным гексаном и сушили в вакууме. Получили 0.74 г (выход 95%) 2-хлор-3-фенилпропилтеллуртрихлорида (II).
2-Хлор-3-фенилпропилтеллуртрихлорид (II). Спектр ЯМР 1Н, d, м.д.: 2.75-2.82 м (1Н, CH2Ph), 3.35 м (1H, CH2Ph), 3.79-3.83 м (1H, CH2Te), 4.00 м (1H, CH2Te), 5.14-5.17 м (1H, CHCl), 7.28-7.37 м (5H, C6H5). Спектр ЯМР 13С, d, м.д.: 44.10 (CH2Ph), 60.40 (CHCl), 69.00 (CH2TeCl3), 126.57 (C6H5), 128.12 (C6H5), 129.23 (C6H5), 137.00 (C6H5). Найдено, %: С 28.04; H 2.78; Cl 36.36. С9Н10Cl4Te. Вычислено, %: С 27.89; H 2.60; Cl 36.59.
2-Бром-3-фенилпропилтеллуртрибромид (III). Спектр ЯМР 1Н, d, м.д.: 2.23-2.27 м (1Н, CH2Ph), 2.54 м (1H, CH2Ph), 3.24-3.26 м (1H, CH2Te), 3.77-3.97 м (1H, CH2Te), 4.90-4.98 м (1H, CHBr), 7.14-7.32 м (5H, C6H5). Спектр ЯМР 13С, d, м.д.: 43.32 (CH2Ph), 46.41 (CHBr), 52.57 (CH2TeBr3), 126.81 (C6H5), 128.40 (C6H5), 129.16 (C6H5), 139.69 (C6H5). Найдено, %: С 18.94; H 1.66; Br 56.82. С9Н10Br4Te. Вычислено, %: С 19.12; H 1.78; Br 56.53.
Бис(2-хлор-3-фенилпропил)селенид (VI). Спектр ЯМР 1Н, d, м.д.: 2.74-2.77 м (1Н, CH2Ph), 3.09-3.13 м (1Н, CH2Ph), 3.19-3.23 м (1H, CH2Se), 3.32-3.34 м (1H, CH2Se), 3.94-4.04 м (1H, CHCl), 7.10-7.25 м (5H, C6H5). Спектр ЯМР 13С, d, м.д.:38.31 (CH2Ph), 44.30 (CH2Se), 62.05 (CHCl), 126.42 (C6H5), 128.02 (C6H5), 128.92 (C6H5), 136.92 (C6H5). Найдено, %: С 56.14; H 5.39; Cl 17.98. С18Н20Cl2Se. Вычислено, %: С 55.98; H 5.22; Cl 18.36.
Бис(2-бром-3-фенилпропил)селенид (VII). Спектр ЯМР 1Н, d, м.д.: 2.44-2.50 м (1Н, CH2Ph), 2.83-2.87 м (1Н, CH2Ph), 2.89-2.94 м (1H, CH2Se), 3.14-3.18 м (1H, CH2Se), 3.63-3.69 м (1H, CHBr), 6.58-6.65 м (5H, C6H5). Спектр ЯМР 13С, d, м.д.: 34.26 (CH2Ph), 40.69 (CH2Se), 50.64 (CHBr), 126.08 (C6H5), 127.33 (C6H5), 128.44 (C6H5), 135.38 (C6H5). Найдено, %: С 45.78; H 4.38; Br 33.87. С18Н20Br2Se. Вычислено, %: С 45.50; H 4.24; Br 33.64.
Результаты и обсуждение
Реакции галогенидов селена и теллура с аллилбензолом не описаны в литературе. Нами впервые изучены реакции присоединения дигалогенидов селена и тетрагалогенидов теллура к аллилбензолу в различных условиях.
Установлено, что реакция тетрахлорида теллура с аллилбензолом (I) в среде четыреххлористого углерода приводит к продукту присоединения по правилу Марковникова, 3-фенил-2-хлорпропилтеллуртрихлориду (II), с выходом 95%.
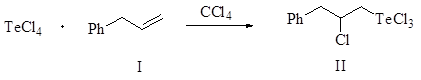
В аналогичных условиях реакция тетрабромида теллура с аллилбензолом в среде четыреххлористого углерода практически не идет. Однако при приведении процесса в среде этилацетата реакция приводит к функционализированному продукту присоединения по правилу Марковникова. Выход 2-бром-3-фенилпропилтеллуртрибромида (III) составляет 72%.
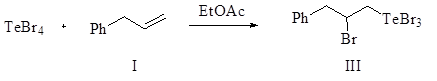
В продолжение систематических исследований реакций дигалогенидов селена с ненасыщенными соединениями [1-10] нами изучено присоединение дихлорида и дибромида селена к аллилбензолу. Реакцию проводили при комнатной температуре в СС14 или хлороформе. Установлено, что реакция приводит к продуктам присоединения против правила Марковникова, бис(1-галоген-3-фенилпроп-2-ил)селенидам (IV, V), которые с течением времени претерпевают перегруппировку и превращаются в термодинамически более устойчивые продукты присоединения по правилу Марковникова, бис(2-галоген-3-фенилпропил)селениды (VI, VII). Найдены условия, позволяющие селективно получить соединения (VI, VII) с высоким выходом.
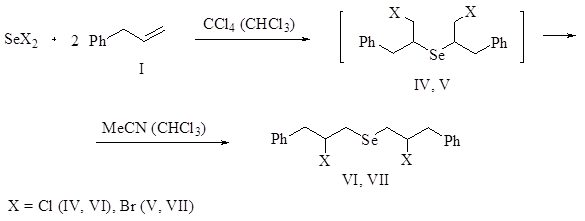
Селениды (IV, V) являются кинетическими продуктами, содержание которых в начальный период реакции составляет более 90% (данные ЯМР) в смеси с продуктами присоединения по правилу Марковникова (VI, VII). Содержание селенидов (IV, V) с течением времени уменьшается, а продуктов (VI, VII) возрастает. В более полярных растворителях, таких как хлороформ и ацетонитрил, перегруппировка идет быстрее, чем в СС14. Установлено, что реакция дихлорида и дибромида селена с аллилбензолом более селективно протекает в СС14, в среде хлороформа или ацетонитрила образуется некоторое количество (около 5-10%) побочных продуктов. Поэтому целесообразно проводить реакцию в СС14, а изомеризацию продуктов присоединения против правила Марковникова проводить в хлороформе или ацетонитриле. На этой основе разработан эффективный способ получения селенидов (VI, VII) с выходом 92-94%.
Изомеризация бромида (V) протекает быстрее, чем хлорида (IV). Это согласуется с тем фактом, что нуклеофильное замещение галогена в алкилбромидах протекает быстрее, чем в алкилхлоридах. Так, реакция дихлорида селена с аллилбензолом в СС14 через 20 ч перемешивания при комнатной температуре приводит к смеси соединений (IV) и (VI) в соотношении 3 : 2, а в реакции дибромида селена в аналогичных условиях превалирует уже продукт присоединения по правилу Марковникова [соотношение соединений (V)/(VII) = 1 : 4]. Можно предполагать, что изомеризация протекает через образование промежуточных селенираниевых катионов [10].
Строение продуктов (II. III, IV, V, VI, VII) доказано методами ЯМР 1H, 13C, а для соединений (II, III, VI, VII) подтверждено данными элементного анализа. Каждый из селенидов (IV, V, VI, VII) представляет собой смесь двух диастереомеров (d,l- и мезо-формы) в соотношении 1:1.
Выводы
Реакции тетрагалогенидов теллура с аллилбензолом протекают региоселективно с образованием продуктов присоединения по правилу Марковникова. Реакция тетрахлорида теллура с аллилбензолом в среде четыреххлористого углерода приводит к 2-хлор-3-фенилпропилтеллуртрихлориду (II) с выходом 95%. При взаимодействии с аллилбензолом тетрабромида теллура в среде этилацетата образуется 2-бром-3-фенилпропилтеллуртрибромид (III) с выходом 72%. На основе реакций дигалогенидов селена с аллилбензолом разработаны региоселективные способы получения продуктов присоединения по правилу Марковникова, бис(2-галоген-3-фенилпропил)селенидов. Получены данные, позволяющие предполагать, что реакции дигалогенидов селена протекают через образование промежуточных кинетических продуктов присоединения против правила Марковникова, бис(1-галоген-3-фенилпроп-2-ил)селенидов, которые с течением времени изомеризуются в термодинамически более устойчивые продукты присоединения по правилу Марковникова, бис(2-галоген-3-фенилпропил)селениды.
Таким образом, на основе реакций дигалогенидов селена и тетрагалогенидов теллура с аллилбензолом разработаны эффективные региоселективные способы получения ранее неизвестных соединений: 2-хлор-3-фенилпропилтеллуртрихлорида, 2-бром-3-фенилпропилтеллуртрибромида (III) и бис(2-галоген-3-фенилпропил)селенидов (VI, VII) − перспективных полупродуктов и синтонов для органического синтеза и реагентов для микроэлектроники.
Работа выполнена при финансовой поддержке Российского научного фонда (проект № 14-13-01085). Основные результаты получены с использованием материально-технической базы Байкальского аналитического центра коллективного пользования Сибирского отделения РАН.
Рецензенты:
Ларина Л.И., д.х.н., ведущий научный сотрудник ИрИХ СО РАН, г. Иркутск.
Мартынов А.В., д.х.н., ведущий научный сотрудник ИрИХ СО РАН, г. Иркутск.



