Актуальность работы обусловлена существенной распространенностью инфекции ВИЧ, которая до настоящего времени не излечима и является причиной летального исхода уже более 2,5 млн. человек. Танатогенез обусловлен поражением иммунной системы с её угнетением, что в свою очередь приводит к СПИД - ассоциированным заболеваниям, до 70% из них это туберкулёз [1,4]. Ко-инфекция ВИЧ/туберкулёз (ВИЧ/ТБ) большей своей частью принадлежит социально дезадаптивным слоям населения РФ и в т.ч. Волгоградской области [2,3,8]. В работах различных ученых описаны причины, приводящие к прогрессированию иммунодефицита у ВИЧ-инфицированных, факторы риска развития и генерализации туберкулёза, которые связаны с девиантными видами поведения, характеризующимися злоупотреблением алкоголя, введением наркотических средств, нарушением режимов химиотерапии и профилактики, с не регулярным приемом химиопрепаратов [2,3,6]. Воздействия вышеуказанных факторов в значительной мере влияют на патоморфологические изменения в различных органах. Важную роль принято отводить печени, так как она выполняет множество функций обмена, ответственна за метаболизм эндогенных веществ и поступающих из вне ксенобиотиков, включая алкоголь, наркотики, лекарственные вещества [10,11,12]. Несмотря на большое количество работ посвященных патологии печени, патоморфологические вопросы при ко-инфекции ВИЧ/ТБ остаются малоизученными.
Цель исследования на аутопсийном материале умерших лиц охарактеризовать патоморфологические изменения в печени при ко-инфекции ВИЧ/ТБ.
Методика исследования. Проведено стандартное гистологическое исследование архивного и самостоятельно изъятого при вскрытиях аутопсийного материала на базе патологоанатомических отделений ГУЗ ВОПАБ, полученного от больных, проживавших на территории Волгограда и Волгоградской области, с подтвержденными лабораторно диагнозами ВИЧ-инфекции и туберкулёза с 2004 по 2014 гг (n=312). С данными аутопсий были сопоставлены и изучены медицинские документы умерших лиц наблюдавшихся в ГУЗ «Волгоградский областной центр по профилактике и борьбе со СПИД и инфекционными заболеваниями» и ГКУЗ «Волгоградский областной клинический противотуберкулезный диспансер» г. Волгоград за период с 2004 по 2014 гг. В 58 % (n=180) у умерших больных было выявлено прижизненное носительство НВV и HCV, что послужило исключением данной группы аутопсийного материала из исследования. Критерием включения в группу исследования были случаи сочетанной «чистой» ко-инфекции ВИЧ/ТБ (n=132). Использовали клинико-иммунологические характеристики умерших больных (СD 4+, СD 8+ с соотношением клеточного индекса СD 4/ СD 8) и вирусологического показателя (вирусная нагрузка (ВН) количество копий РНК ВИЧ в миллилитре) полученных методом проточной цитометрии при последнем анализе прижизненно, а также данные о приверженности к терапии антиретровирусной (АРВТ, ВААРТ) и противотуберкулёзной (ПТП).
Результаты исследования и их обсуждение. В изучаемом материале (n=132) патоморфологические изменения в печени наблюдались в 100% случаев. Печень в большинстве случаев была резко увеличена, полнокровна, средняя масса составила (медиана) 4083 гр. Между диафрагмой и поверхностью печени нередко обнаруживались спайки. Печень часто имела глинистую консистенцию, желто-коричневый цвет, нижний край, как правило, был закруглен, в некоторых случаях наблюдали мелкую бугристость капсулы. Поражение печени в ряде случаев носило специфический туберкулёзный характер в 30 % случаях (n=39). Наблюдалась милиарная диссеминация капсулы и/или паренхимы в виде просовидных диффузных высыпаний серо-желтого цвета, которые находились под капсулой, что сочеталось с участками мускатного вида, которые располагались в виде мозаики. В паренхиме обнаруживались очаги диссеминации со сглаженностью рисунка органа на разрезе. Микроскопически обнаруживались множественные эпителиоидно-клеточные формирующиеся гранулемы часто без казеозного некроза с макрофагальным компонентом, с участием гигантских клеток Пирогова-Лангханса, со слабо выраженной перифокальной лимфоидной инфильтрацией и умеренной экссудативной реакцией (Рис.1). Количество макрофагов и клеток Пирогова-Лангханса зависело от выраженности иммунной депрессии, с исчезновением последних в воспалительном инфильтрате. Такие специфические воспалительные изменения чаще выявлялись у лиц, которые отказывались или нарушали режимы приема АРВТ и ПТП, умерших от милиарных форм туберкулёза с множественными локализациями и/или диссеминированными процессами в легких с одной уточнённой локализацией в печени на фоне иммунной анергии с резким снижением CD 4+ лимфоцитов медиана составила 51,8 клеток/мкл, медиана количества CD 8+ лимфоцитов – 598,1 клеток/мкл, медиана иммунорегуляторного индекса – 0,09, и высокой вирусной нагрузкой, уровень ВН по медиане составил 308545 РНК HIV кл/мл. Хотелось бы отметить, что параметры, характеризующие иммунный статус были выше у умерших лиц со специфическим поражением печени, которые принимали АРВТ в сочетании с ПТП: CD 4+ медиана составила 96,4 клеток/мкл, медиана количества CD 8+ лимфоцитов – 492,4 клеток/мкл, медиана иммунорегуляторного индекса – 0,20, а также наблюдалась более низкая вирусная нагрузка от 68000 до неопределяемой. Явления микроциркуляторных расстройств в виде венозного полнокровия с расширением центральных вен и синусоидных капилляров обнаруживались в 71% случаев (n=93). Также на структурном уровне можно отметить расширение перисинусоидальных пространств Диссе вследствие отека и диапедеза эритроцитов, там же обнаруживались гипертрофированные клетки Купфера, количество которых было снижено, что возможно связано с иммунодефицитом. Кроме того, наблюдались явления внутрипеченочного холестаза с признаками обструкции жёлчных ходов и формирования «жёлчных озёр» с фиброзом. Дистрофические изменения гепатоцитов выявлялись в 100% случаев (Рис. 2.). Картина жировой дистрофии гепатоцитов выявлялась в 78% случаев (n=103), что на светооптическом уровне при окраске гематоксилином и эозином проявлялось в виде множества пустот различных размеров в гепатоцитах со смещением ядра/ядер на периферию в некоторых случаях с необратимыми процессами в виде некрозов гепатоцитов, нередко такие изменения сочетались с фиброзом портальных трактов различной выраженности в 38% случаев (n=50), с их инфильтрацией мононуклеарами и перестройкой с нарушением дольковой архитектоники. Инфильтративные изменения были наиболее выражены по ходу септ, но также имел место их выход за пределы соединительной ткани. В нескольких случаях в гепатоцитах обнаруживали гиалиново-капельную дистрофию, включения в виде телец Маллори, с наличием пограничных некрозов и большого количества плазматических клеток. Гидропическая дистрофия гепатоцитов обнаруживалась в 49% случаев (n=65), участки пораженного органа располагались мозаикой в виде очагов, клетки печени были гипертрофированы, отечны, в их цитоплазме выявлялись вакуоли, ядро/ядра, как правило, смещались на периферию, не редко наблюдали изменения в виде кариопикноза и кариолизиса с образованием «пустой» цитоплазмы, как признак тотального колликвационного некроза. Кроме того, в наблюдения попали 16% случаев (n=21) с формирующимися микроабсцессами, которые характеризовались участками фибриноидного набухания стенок артериол, пролиферацией эндотелия, нейтрофильной инфильтрацией и фибриноидными некрозами, которые в 100% случаев обнаружены у инъекционных наркопотребителей, выявлялись очаги резко выраженной гиперплазии и атипии эпителия междольклвых желчных протоков и холангиол с признаками внутридолькового холестаза в 1% случаев (n=1).
Неспецифические изменения характеризовались также наличием мононуклеарных агрегатов в части портальных трактов, разрушением перипортальной пластинки, выявлением отдельных некровоспалительных фокусов в дольках в виде умеренно выраженных ступенчатых некрозов, захватывающих менее чем 50% периметра большинства портальных трактов.
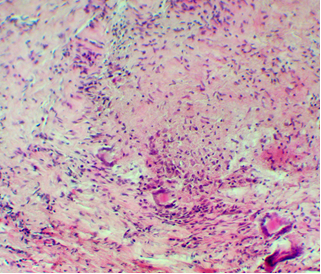
Рис.1. Эпителиодно-клеточная гранулема с казезным некрозом и клетками Пирогова-Лангханса. Небольшое количество малых лимфоцитов. Дистрофия гепатоцитов. Больной Л., 27 лет, ВИЧ/ТБ
Окр. Гематоксилин-эозин. Ув. х 100.
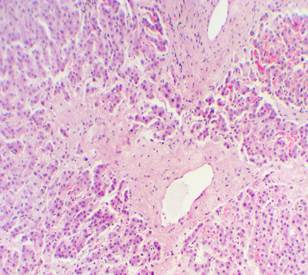
Рис. 2. Выраженный фиброз портальных трактов с лимфо-гистиоцитарной инфильтрацией. Дистрофия гепатоцитов. Больной Ц., 23 года (героиновая) зависимость.
Окр. Гематоксилин-эозин. Ув. х 100.
Таким образом, морфологическая картина повреждений печени при ко-инфекции ВИЧ/ТБ характеризовалась специфическими туберкулёзными гранулематозными реакциями в 30% с макрофагальным компонентом с единичными или без клеток Пирогова – Лангханса, редко с формированием казеозного некроза. Причина таких изменений гематогенная диссеминация микобактерий туберкулёза при отсутствии адекватной Т-клеточной иммунной защиты в результате цитотоксического действия ВИЧ на СD 4+ Т-лимфоциты (медиана ВН составила 308545 РНК HIVкл/мл), а также в результате дисбаланса провоспалительных и противовоспалительных цитокинов, влияющих на макрофагальную активность через Th-1 и Th-2 лимфоциты с активацией апоптоза [5]. ВИЧ, блокирует экспрессию ИЛ-2 рецепторов на Т-лимфоцитах, что обуславливает угнетение клеточного иммунного ответа на МБТ, кроме того, необходимо учитывать роль макрофагов, которые не подвержены цитопатическим эффектам ВИЧ, но являются резервуаром, как вируса, так и микобактерий туберкулёза, обеспечивая доступ возбудителей через кровяные и тканевые барьеры, что, возможно, провоцирует генерализацию туберкулёза экстрапульмонарно гематогенным путем [5,9]. Различные виды дистрофических изменений гепатоцитов выявлялись в 100% случаев, не редко имели смешанный характер, сочетались с очаговыми некротическими изменениями, с различным по выраженности фиброзом портальных трактов в 38% вплоть до цирроза. Отмечалось развитие продуктивных васкулитов на фоне нарушений кровообращения и дистрофических изменений в эндотелии сосудов в виде фибриноидного набухания стенок артериол, которое заканчивалось фибриноидным некрозом и образованием микроабсцессов в печени в 16% случаев. По-видимому, выше указанные неспецифические изменения могут быть связаны с различными токсическими воздействиями на клетки печени и сосуды, с нарушениями обмена веществ, которые клинически сопровождались повышением в крови уровней триглицеридов, холестерина и глюкозы с развитием липодистрофии у ВИЧ-инфицированных на поздних стадиях при наркотической зависимости [7,11,12,13]. Факторами риска повреждения печени считается хронический приём психоактивных веществ, в том числе алкоголя [11,12]. В нашем исследовании четко прослеживается роль алкоголя в повреждении печени, включая в себя стадийный процесс: стеатоз, гепатит, цирроз, что морфологически подтверждается наличием баллонной и жировой дистрофией с центролобулярными некрозами, нарушениями микроциркуляции, воспалительной реакцией с нейтрофильной инфильтрацией, фиброзом портальных трактов различной выраженности и отложениями алкогольного гиалина – телец Маллори [10]. Кроме того, токсическое действие на печень характерно для большинства ВААРТ и ПТП [13]. Гепатоксическое действие обусловлено прямыми токсическими эффектами препаратов, иммуноаллергическими и дисметаболическими реакциями. Кроме того, выделяют идиосинкразические гепатопатии, которые развиваются только у «восприимчивых» пациентов, а также в результате воздействия факторов окружающей среды. Механизмы таких воздействий связаны с метаболизмом ферментов детоксикации ксенобиотиков[12]. Суперсемейства цитохрома - P450, могут трансформироваться в токсические формы, например, N-ацетил-p-бензоквинонеимин под воздействием алкоголя, а также ферменты N-ацетил трансферазы - NAT2 с их генным полиморфизмом в результате мутаций у разных больных могут приводить к повреждению клеточных структур гепатоцитов в результате снижения скорости ацетилирования в организме с задержкой элиминации лекарственных веществ [12]. ПТП проявляют выраженную гепатотоксичность. Изониазид, препарат I ряда и назначается при ВИЧ/ТБ ко-инфекции, даже в случаях с широкой лекарственной устойчивостью, в первые месяцы лечения острый гепатоцеллюлярный некроз обнаруживается у 20% больных туберкулёзом, а длительное применение ПТП без гепатопротективной поддержки может привести к циррозу печени [11]. В диссертационной работе Меркулова С. А. «Лекарственно-индуцированные поражения печени у больных туберкулёзом легких: оптимизация лечения и профилактики» установлено, что при развитии лекарственно-индуцированного поражения печени на фоне противотуберкулезной терапии наблюдается стойкий дисбаланс Т-клеточного иммунитета с гипосупрессией CD3, CD4, CD16, с повышением уровня цитотоксических Т-лимфоцитов CD8 и значимым снижением иммуннорегуляторного индекса, выраженными нарушениями цитокиновой регуляции с достоверной гиперпродукцией ФНО-α, ИЛ-4 и ИЛ-6, коррелирующей со степенью выраженности повреждения печени. Похожие, но более выраженные изменения, Т- клеточного звена иммунитета с инверсией клеточного соотношения, обнаружены нами у умерших больных прижизненно, что сопровождалось выше представленными морфологическими изменениями в печени, продемонстрированными на аутопсийном материале при ко-инфекции ВИЧ/ТБ.
Заключение
Таким образом, при исследовании печени лиц, умерших от ВИЧ/ТБ ко-инфекции, морфологически выявлены специфические туберкулёзные изменения в 30% случаев, что характеризовалось милиарной диссеминацией в капсуле и/или в паренхиме в виде просовидных диффузных бугорков. На светооптическом обнаруживались множественные эпителиоидно-клеточные формирующиеся гранулемы без казеозного некроза с макрофагальным компонентом, реже с участием гигантских клеток Пирогова-Лангханса, со слабо выраженной перифокальной лимфоидной инфильтрацией и умеренной экссудативной реакцией. Количество макрофагов и клеток Пирогова-Лангханса в воспалительном фокусе, зависело от выраженности иммунной депрессии, что по лабораторным данным характеризовалось значительным снижением СD 4+ лимфоцитов и СD 8+ клеток с резкой инверсией иммунорегуляторного индекса СD4/СD8 и высокой вирусной нагрузкой. Различные виды дистрофических изменений гепатоцитов выявлялись в 100% случаев, не редко имели смешанный характер, сочетались с очаговыми некротическими изменениями, с различным по выраженности фиброзом портальных трактов в 38%, а также отмечалось развитие продуктивных васкулитов на фоне нарушений кровообращения с фибриноидным некрозом стенок артериол и образованием микроабсцессов в печени в 16% случаев, что обусловлено прижизненными полиэтиологическими факторами: экзогенного характера - хронический прием алкоголя, наркотиков, химиопрепаратов; эндогенного характера нарушение иммунорегуляции с цитокиновой дискордантностью.
Рецензенты:
Ермилов В.В., д.м.н., профессор кафедры судебной медицины Волгоградского Государственного медицинского университета, г. Волгоград;
Смирнов А.В., д.м.н., профессор, заведующий кафедрой патологической анатомии Волгоградского Государственного медицинского университета, г. Волгоград.



