Одной из причин загрязнения природных вод солями тяжёлых металлов является размещение в окружающей среде шлаков их выплавки, отходов обогащения руд этих металлов, в некоторых случаях попадание в среду отходов гальванических производств. Исключение попадание в природную среду таких техногенных отходов, по-видимому, встречает определённые технологические и организационные затруднения, в связи с чем, для защиты биосферы от воздействия токсичных солей тяжёлых металлов необходимо уменьшить остаточное содержание их соединений в таких отходах. Определённый интерес представляет извлечение из техногенных отходов цинка, так как по массе и тоннажу отходов цинк занимает третье место среди цветных металлов после алюминия и меди, ПДК ионов цинка по рыбному хозяйству существенно меньше ПДК для ионов ряда других цветных металлов.
Извлечение цветных металлов, образующих растворимые аммиакаты, из техногенных отходов, в частности цинка, путём их суспендирования в совместных растворах аммиака и хлорида аммония является одним из перспективных методов очистки отходов от соединений тяжёлых металлов и защиты от загрязнения этими соединениями природных вод. Для выделения соединений тяжелых металлов из аммиачного раствора необходима отгонка из него аммиака, ведущая к разрушению амминокомплексов и осаждению оксидов металлов. Для минимизации потерь аммиака при его отгонке необходимы данные по давлению NH3 над образующимися растворами. Известны [2] методы расчета содержания NH3 в газовой фазе над совместным раствором аммиака и NH4Cl в воде, применимым [4] для извлечения цветных металлов, но образование амминокомплексов в растворе влияет на летучесть аммиака, что ограничивает пригодность известных расчётных уравнений вычислением давления аммиака только над исходными экстрагирующими растворами, не содержащими ионов металлов.
Априорно, на основании известных исследований невозможно указать направление изменений летучести аммиака при накоплении в аммиачно-аммонийном растворе комплексов переходных металлов с аммиаком. С одной стороны, комплексообразование уменьшает концентрацию «свободного» (гидратированного, но не связанного в комплексы аммиака), что соответствует понижению давления NH3 над раствором (РNH3). С другой стороны, катионы амминокомплексов, как и другие ионы, могут высаливать аммиак [3] из водного раствора за счёт разрушения исходной структуры растворителя и вызывать рост РNH3 в изотермических условиях. В литературе нет данных для суждения о соответствии или несоответствии понижения способности аммиака из аммиачно-аммонийных растворов десорбироваться в газовую фазу формированию известных [1,6] тетрааммонийных комплексов цинка. Для сравнения отметим, что уменьшение парциального давления аммиака над аммонийно-аммиачном раствором при внесении в него всего 1 г/л меди (II), многократно превышает возможные изменения РNH3, адекватные образованию тетрааммиакатов меди [5].
Цель работы
Изучение зависимости парциального давления аммиака над совместным водным раствором аммиака, хлорида аммония и аммиакатов цинка от содержания последних, установление направления и природы воздействия изменения концентрации цинксодержащих комплексов на величину РNH3. Разработка методики расчёта парциального давления аммиака по составу растворов, содержащих аммиак, хлорид аммония, аммиакаты цинка.
Методика исследования
Значение РNH3 над совместными растворами аммиака, хлорида аммония и соединений цинка определяли динамическим методом, применённым в работах [2,5]. Аммонийно-аммиачный раствор готовили, растворяя точно известные навески NH4Cl в аммиачной воде, содержащей порядка 5 и 10% масс. NH3. Отклонения содержания аммиака в аммиачной воде от указанных концентраций в отдельных пробах не превышали по модулю 0,6% масс. Хлорид аммония вносили навесками равными (5, 10) ± 0,2 г/100 мл раствора. Соединения цинка вводили в аммонийно-аммиачный раствор или внесением хлорида цинка квалификации х.ч. или растворением оксида цинка, полученного прокаливанием свежеосаждённого гидроксида цинка. Содержание в растворе ионов цинка было известно по приготовлению, так как массу ZnO подбирали таким образом, чтобы обеспечить полное растворение оксида. Состав изученных растворов соответствует составу экстрагентов, которые могут быть применены для извлечения цинка из техногенных отходов.
Результаты эксперимента
В таблице 1 приведены составы изученных растворов, содержащих аммиак, хлорид аммония и соединения цинка, экспериментальные и расчётные значения равновесного парциального давления аммиака над этими растворами при 293 К. Метод расчета давления аммиака изложен ниже. В отдельных сериях опытов при приблизительно постоянных концентрациях аммиака и хлорида аммония, приблизительно соответствующих составу аммонийно-аммиачных растворов, не содержащих цинка (растворы № 1, 6, 9, 13), варьировали содержание комплексов цинка. Влияние концентрации NH4Cl на РNH3 изучено ранее [2]. Интервал изменения концентраций аммиака (3,2 − 6,3 моль/1000 г воды) и NH4Cl (1,1 − 2,25 моль/1000 г воды) соответствует составу растворов, которые могут быть применены для извлечения соединений цинка из технических отходов. Из таблицы 1 видно закономерное уменьшение парциального давления аммиака над изученными растворами, незначительно различающимися по содержанию аммиака и хлорида аммония, с ростом концентрации соединений цинка. Можно сделать вывод о преобладании связывания аммиака ионами цинка над возможным высаливающим действием аммиакатов цинка.
Таблица 1
Состав изученных растворов и равновесные значения РNH3 при 293 К
|
№ опыта |
Концентрации компонентов моль /1000 г воды |
РNH3, кПа |
|||
|
аммиак |
NH4Cl |
[Zn (NH3)x ]+2 |
расчёт |
эксперимент |
|
|
1 |
6,02 |
1,1 |
––– |
13,89 |
13,71 |
|
2 |
5,75 |
1,11 |
0,12 |
9,83 |
10,14 |
|
3 |
5,73 |
1,09 |
0,38 |
4,95 |
5,16 |
|
4 |
6,11 |
1,09 |
0,67 |
2,64 |
2,64 |
|
5 |
6,35 |
1,09 |
1,11 |
0, 49 |
0,44 |
|
6 |
6,15 |
2,15 |
––– |
13,20 |
12,96 +1,85% |
|
7 |
6,14 |
2,16 |
0,36 |
5,97 |
5,90 |
|
8 |
6,19 |
2,12 |
0,70 |
2,38 |
2,29 |
|
9 |
3,32 |
1,08 |
––– |
6,67 |
6,75 |
|
10 |
3,32 |
1,04 |
0,15 |
3,85 |
4,0 |
|
11 |
3,29 |
1,08 |
0,41 |
1,0 |
1,05 |
|
12 |
3,43 |
1,12 |
0,69 |
0,54 |
0,58 |
|
13 |
3,32 |
2,25 |
––– |
6,34 |
6,30 |
|
14 |
3,35 |
2,19 |
0,16 |
3,54 |
3,49 |
|
15 |
3,34 |
2,16 |
0,38 |
1,43 |
1,48 |
|
16 |
3,42 |
2,26 |
0,70 |
0,045 |
0,06 |
Для анализа влияния содержания ионов цинка на давление аммиака над раствором для каждого изученного раствора, содержащего цинк, вычислена концентрация «свободного» аммиака, соответствующая определённой из опыта величине PNH3. Вычисление вели по уравнениям (1)–(3), применимость которых к растворам аммиака и хлорида аммония в воде обоснована ранее [2]. Адекватность описания уравнениями (1)–(3) зависимости содержания NH3 в воде от его давления подтверждается хорошим совпадением расчетных и опытных значений PNH3 для растворов 1, 6, 9, 12 по таблице 1, содержащих аммиак и соль аммония.
С0-1 = А1 + B1 PNH3-1 (1)
lgC = lg C0 - k C2 (2)
lg k = 0,4 - 0,27 C20,333 (3)
В уравнениях (1)–(3) С0, C и C2 моляльные концентрации, соответственно, аммиака в аммиачной воде, аммиака в совместном растворе аммиака и хлорида аммония, PNH3 − равновесное парциальное давление аммиака, кПа, коэффициенты А1, В1 для 293 К равны [2] равны 0,024 и 1,335.
В проведённых расчётах по определённому на опыте значению PNH3 вычисляли соответствующее значение С0, то есть концентрацию аммиака в чистой аммиачной воде, отвечающую принятой величине парциального давления аммиака. Далее находили из уравнений (2) и (3) значение C для раствора NH3 и NH4Cl, концентрация хлорида аммония в котором соответствовала той же величине для исследованного раствора аммиака, хлорида аммония и аммиакатов цинка. Вследствие высаливания аммиака солью аммония С меньше, чем С0. Разность [NH3] – С, где [NH3] − аналитически определённая концентрация аммиака, которая соответствует, по нашему мнению, количеству аммиака, связанного с ионами цинка.
Известно, что в растворах, где мольное отношение аммиака к ионам цинка больше четырёх, большая часть ионов цинка образует тетрааммиакаты [Zn(NH3)4]+2 [1,6]. Из таблицы 2, в которой приведены экспериментальные величины отношения ([NH3]-С)·[Zn]-1, (α) видно, что ионы цинка уменьшают способность к переходу в газовую фазу большего числа молей аммиака, чем это отвечает формуле тетрааммиаката.
Таблица 2
Экспериментальные значения отношения ([NH3]-С)/[Zn] в изученных растворах
|
№ раствора |
2 |
3 |
4 |
5 |
7 |
8 |
10 |
11 |
12 |
14 |
15 |
16 |
|
([NH3]–С)/[Zn] |
9,86 |
8,32 |
7,07 |
5,48 |
8,57 |
6,98 |
9,0 |
6,68 |
4,93 |
8,92 |
6,96 |
4,85 |
Нумерация растворов в таблице 2 соответствует таблице 1.
В качестве рабочей гипотезы, объясняющей столь значительное влияние наличия цинка в аммиачно-аммонийном водном растворе на концентрацию аммиака, способного к испарению из раствора при 293 К, мы не рассматриваем образования аммиачных комплексов цинка с координационным числом по аммиаку более 4-х. Можно предположить, что при избытке аммиака имеет место гидратация ионов [Zn(NH3)4]+2 молекулами воды, входящими в гидраты аммиака NH3∙Н2О, что в свою очередь, уменьшает летучесть аммиака. Отметим в пользу этого предположения, что меньше содержание цинка в растворе при относительно постоянном содержании аммиака увеличивает отношение ([NH3]–С)/[Zn] и, наоборот, при максимально достигнутой концентрации цинка около 0,7 моль/1000 г воды в бедных по аммиаку растворах 12 и 16 это отношение близко к координационному числу цинка по NH3.
Для разработки методики расчета парциального давления аммиака над содержащим цинк аммонийно-аммиачным раствором целесообразно рассмотреть зависимость от состава раствора величины α равной ([NH3]–С)/[Zn] и характерного для цинка координационного числа по аммиаку равного 4. В качестве аргумента зависимости принято отношение концентрации аммиака, не связанного в тетрааммиакаты цинка, к концентрации цинка в растворе равное {[NH3]–4∙[Zn]}/[Zn]. На рисунке представлен график зависимости α–4 от указанного отношения, представляющий собой плавную кривую, асимптотически приближающуюся к некоторому пределу с ростом {[NH3]–4∙[Zn]}/[Zn]. Ни в одном из опытов величина α–4 не превышает 6, что укладывается в принятую рабочую гипотезу о гидратации ионов [Zn(NH3)4]+2 молекулами воды, входящими в гидраты аммиака NH3∙Н2О, как причине аномального уменьшения летучести аммиака. Гидратное число, равное 6, достижимо для диссоциирующей соли [Zn(NH3)4]Cl2.
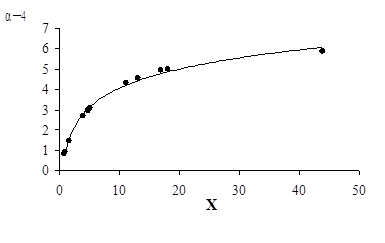
Зависимость величины (α–4), моль NH3/моль цинка, от Х – отношения концентрации не связанного в тетраамминные комплексы NH3 к концентрации цинка. Х равен {[NH3]-4∙[Zn]}/[Zn]-1
Зависимость α–4 от отношения концентрации «свободного» аммиака к содержанию цинка аппроксимирована уравнением вида:
(α-4)-1 = А + В Х-1 (4)
Уравнения в обратных координатах, как правило, позволяет линеаризировать зависимости, сущность которых состоит в асимптотическом приближении численного значения функции с ростом аргумента к некоторому заранее неизвестному пределу. При А, равном 0,15, и В, равном 0,9, уравнение (4) удовлетворительно описывает рассматриваемую зависимость.
Вычисление величины α по аналитически определённым концентрациям аммиака и цинка позволяет определить концентрацию активного аммиака, равную [NH3]-α [Zn], соответствующую величине C в уравнении (2). Далее по уравнениям (2) и (3) вычисляется величина C0 и по уравнению (1) соответствующее значение парциального давления аммиака.
Вычисленные таким образом расчетные значения РNH3 внесены в таблицу 1. Сопоставление расчетных и экспериментальных величин РNH3 показывает, что ошибка расчёта по отношению к опытным величинам не превышает ±4%, кроме растворов, над которыми давление аммиака менее 0,6 кПа. Средняя ошибка близка к ±2 %. Большая величина относительной ошибки для растворов, отличающихся величиной РNH3 менее 0,6 кПа (при абсолютной величине ошибки расчета порядка сотых долей кПа), связана с тем, что для таких растворов нельзя считать среднее координационное число цинка по аммиаку, близким к 4. Таким образом, разработанный метод расчета обеспечивает вычисление парциального давления аммиака над совместным водным раствором аммиака, хлорида аммония и соединений цинка по его составу с точностью достаточной для технических целей.
Выводы
Изучена зависимость парциального давления аммиака над совместным водным раствором аммиака, хлорида аммония и соединений цинка при 293 К.
Разработан метод расчёта давления аммиака с ошибкой, не превышающей ±4%, по составу раствора, применимый при содержании аммиака до 6,2 моль/1000 г воды, хлорида аммония до 2,2, цинка до 0,7 моль/1000 г воды.
Рецензенты:
Ульянов В.М., д.т.н., профессор кафедры «Машины и аппараты химических и пищевых производств» ДПИ НГТУ им. Р.Е. Алексеева, г. Дзержинск;
Ким П.П., д.т.н., профессор, кафедра ПАХПТ, ДПИ НГТУ им. Р.Е. Алексеева, г. Дзержинск.



