Особенностью современного этапа развития российского фармацевтического рынка является значительный ежегодный рост и доминирование импорта, приводящее к невозможности достижения фармацевтической безопасности страны, определенную Всемирной организацией здравоохранения как соотношение 70 : 30, где последнее - импорт.
Следствием геополитических событий на Украине является введение нескольких пакетов санкций в отношении отдельных организаций, лиц и секторов экономики России. Данная тенденция, по-нашему мнению, может нести угрозу системе лекарственного обеспечения страны. В данных условиях актуализируется проблема импортозамещения лекарств.
Целью исследования является определение направлений развития фармацевтической отрасли России, а также проблем, нивелирующих данный процесс, в условиях внешнеэкономических и внешнеполитических ограничений со стороны США и Европейского союза.
Материалы и методы исследования. Законодательные и нормативные акты в сфере здравоохранения и фармации Российской Федерации. В процессе исследования использовались методы: контент-анализ, экономико-статистический анализ.
Результаты и обсуждение
Характерной особенностью российского фармацевтического рынка являются высокие ежегодные темпы роста (в 2005 - 35 %, в 2006 - 36 %, в 2007 - 16 %, в 2008 - 25 %, в 2009 г. - 18 %, в 2010 - 9 %, в 2011 - 12 %, в 2012 и 2013 гг. - 12 и 14 %), сочетающейся с высокой долей импорта лекарственных средств (ЛС) - до 85 % [1, 6] (рис. 1).
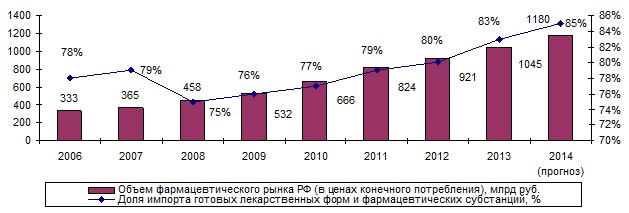
Рис. 1. Динамика показателей российского фармацевтического рынка в 2006 - 2013 гг.
При этом в структуре импорта лидируют компании Германии (21,6 %) и Индии (6,1 %). ТОП-10 продаваемых в России лекарств также возглавляют импортные фармпродукты - Эссенциале, Конкор, Актовегин, а ТОП-10 фармкомпаний - иностранные производители Novartis, Sanofi-Aventis и др. [6].
В 2012-2014 гг. ежегодно утверждаемый Правительством РФ перечень лекарственных препаратов для медицинского применения, обеспечивающих приоритетные потребности здравоохранения в целях профилактики и лечения заболеваний, содержал 567 жизненно важных наименований препаратов, из которых 93 наименования (16,4 %) производятся только отечественными производителями, 207 наименований (36,5 %) производятся только зарубежными производителями, а производство 267 наименований (47,1 %) лекарственных препаратов осуществляется как российскими, так и иностранными фармацевтическими предприятиями [2].
Однако существенным фактором, претендующим на доминирование в отношении влияния на динамику развития российского фармацевтического рынка, являются ограничительные политические и экономические меры, введённые со стороны Европейского союза и США в отношении России и ряда российских лиц и организаций вследствие геополитического противостояния на Украине.
Несмотря на то, что введенный в начале сентября 2014 г. новый пакет санкций, непосредственно не ограничивает импорт медикаментов и оборудования для фармацевтической промышленности, сфера лекарственного обеспечения по-прежнему остается узким местом в системе национальной безопасности.
В случае гипотетически возможной экономической блокады, при которой в страну перестанут ввозиться стратегически важные ресурсы, Россия может столкнуться с серьезными проблемами нехватки фармпродукции, а также оборудования для ее производства [7]. Так, к примеру, во время вооруженного конфликта в Северной Осетии в 2008 г. российские нефтеперерабатывающие заводы простояли без работы, так как не получили специальных присадок для производства бензина.
В то же время, необходимость внедрения возмещаемых программ лекарственного обеспечения, охватывающих основную часть населения России, признана и на уровне экспертного сообщества, и на уровне Правительства РФ, и соответствующие планы закреплены в принятой ФЦП «Развитие фармацевтической и медицинской промышленности Российской Федерации на период до 2020 года и дальнейшую перспективу» на основе Стратегии «Фарма-2020» и Федерального закона Российской Федерации от 12 апреля 2010 г. № 61-ФЗ «Об обращении лекарственных средств» [1].
Разработка и реализация указанной ФЦП имеют императив решения проблемы провала в системе «доведения» результатов фундаментальных исследований до промышленного производства. ФЦП рассматривается как инструмент, обеспечивающий переход отечественной фармацевтической и медицинской промышленности на инновационную модель развития путем создания 17 научно-исследовательских центров мирового уровня, из которых 10 - по разработке новых лекарственных средств, 7 - по разработке медицинской техники и изделий медицинского назначения. Общее финансирование ФЦП планировалось на уровне 185 млрд руб., но Минпромторг России неоднократно заявлял о планах его снижения [1].
Импортозамещение можно рассматривать как процесс замены на внутреннем рынке фармацевтической продукции, производимой вне границ Российской Федерации, конкурентоспособной и не уступающей по параметрам качества и ценовым характеристикам мирового рынка, фармацевтической продукцией, производимой в границах Российской Федерации [5].
В то же время можно выделить проблемы, которые прямо или косвенно препятствуют реализации курса на импортозамещение, провозглашенного в указанных программных документах.
Реальность достижения заявленных в ФЦП «Развитие фармацевтической и медицинской промышленности Российской Федерации на период до 2020 года и дальнейшую перспективу» результатов неоднократно ставилась под сомнение отраслевыми специалистами вследствие длительности разработки инновационных ЛС (до 14 лет), дефицита площадок под строительство заводов с необходимым пакетом услуг по инфраструктуре (особенно важно для компаний, заинтересованных в локализации производства в России), неудовлетворительного состояния отраслевой науки (разрушение НИИ, недостаток научных работников), несовершенства законодательства в области защиты прав интеллектуальной собственности [1].
На период 2014-2017 гг. приходится основной пик госфинансирования российской фарминдустрии - 68 млрд руб. [4], однако вызывает сомнение возможность реализации антикризисных мер в условиях планирующегося бюджетного дефицита в 0,5 % ВВП и снижения доходов в связи с обострившейся международной обстановкой.
Отечественные фармкомпании, несмотря на более низкую стоимость создания нового фармпродукта в России (до 60-80 млн руб.), ориентированы, в первую очередь, на производство и маркетинг дженериков (лекарства-копии). Уровень финансирования ими НИОКР составляет 1 - 2 % от выручки (необходимый уровень - 18 %) [1].
Значительная часть российских фармпроизводителей ограничена в собственных средствах как в источнике финансирования инновационной деятельности, что является следствием их низкомаржинального продуктового портфеля. Использование банковских кредитов вследствие недостаточной платежеспособности фармкомпаний и высоких проектных рисков не имеет достаточного распространения. Применение широко распространенной в мире формы привлечения финансовых ресурсов - венчурные инвестиции - не развито по причине отсутствия достаточной интеграции между разработчиками и производителями лекарств, консервативизма бизнес-модели фармпризводителя (существование в сегменте дешевых дженериков без попыток инновационной деятельности), несовершенства законодательства в сфере интеллектуальной собственности (риск присвоения препарата производителем).
Прирост производства фармпродукции указывает имеет характер вследствие доминирования в нем дженериков (рис. 2) [1].
Также необходимо отметить, что зачастую регистрируемые инновационные продукты являются либо реализацией проектов, существовавших еще в советский период (например, Арбидол), либо маркетинговой инновацией, состоящей в перепозиционировании лекарства посредством комплекса маркетинговых коммуникаций из одного сегмента в другой, несмежный первоначальному (например, Ингавирин, действующее вещество которого применяется в онкологии) [1].

Рис. 2. Структура прироста производства фармпродукции в 2013 г.
Другой существенной проблемой отрасли является обязательный переход с 01.01.2014 г. фармацевтического производства на международный отраслевой стандарт GMP в соответствии с Федеральным законом «Об обращении лекарственных средств», рассматриваемый как непременное условие дальнейшей легальной производственной и маркетинговой деятельности фармкомпаний на территории России.
В настоящее время по разным оценкам переход на данный стандарт осуществлен лишь 15 % российских предприятий. Сложность получения сертификата GMP заключается в необходимости приведения в соответствие с международными требованиями самих производств, помещений, где они располагаются, а также разработки регламентов, документов по качеству и обязательном обучении персонала.
Вступление России в ВТО (Федеральный закон «О ратификации Протокола о присоединении Российской Федерации к Марракешскому соглашению об учреждении Всемирной торговой организации от 15 апреля 1994 г.» № 126-ФЗ от 21 июля 2012 г.) внесло существенные коррективы в развитие отрасли. С одной стороны, снижения пошлинных ставок на импортные ЛС с 15 % до 6,5 %, фармацевтических субстанций - с 10 % до 2 - 3 % [1] в течение 2-3 лет должно снизить стоимость импортных препаратов и удешевить производство российских, а, с другой, рост импортного прессинга способен привести к закрытию многих существующих предприятий.
Возможным путем создания собственной инновационной базы фармпредприятий могла бы стать ступенчатая стратегия постепенного перехода от производства низших дженериков (старые препараты-копии) к высшим (с небольшим сроком потери патентной защиты), маркетинг которых позволил бы обеспечить рост финансового потенциала [3].
Однако препятствием такому сценарию является предполагаемая адаптация российского законодательства к норме эксклюзивности данных («Data exclusivity»), являющейся инструментом защиты интеллектуальной собственности в отношении оригинальных инновационных лекарств при их регистрации и введении в гражданский оборот в США и странах ЕС. Российское патентное законодательство запрещает использование в течение 20 лет изобретения, относящегося к лекарственному средству, без разрешения правообладателя. Однако дженериковая фармкомпания может зарегистрировать свое лекарственное средство в период действия патента оригинального, с использованием данных клинических исследований последнего и начать производство и маркетинг с момента истечения срока действия патента. При этом срок патентной защиты отсчитывается от подачи заявки на патент, а не от начала продаж лекарств, что снижает общую доходность продаж оригинального препарата. При вступлении нормы эксклюзивности данных российские производители дженериков будут ограничены в правах в течение 6 лет после истечения срока действия патента использовать результаты клинических исследований оригинального препарата [1].
Также к нерешенным вопросам можно отнести избыточную длительность регистрации медпрепаратов. В настоящее время регистрация лекарственных препаратов Министерством здравоохранения официально ограничена 210 днями (7 месяцев), однако вследствие бюрократических проволочек сроки процедуры могут значительно увеличиваться. Данная ситуация приводит к невозможности осуществлять производственно-коммерческую деятельность.
Решение данной проблемы требует создания условий отечественным производителям в направлении сокращения процедуры регистрации в два раза - до 100 дней, а ускоренной регистрации для дженериков - 60-50 дней.
Выводы
Таким образом, в настоящее время в условиях ограничительных политических и экономических мер, введённых со стороны Европейского союза и США в отношении России, общепризнанным является приоритет лекарственного обеспечения населения страны за счет внутреннего фармпроизводства, которое в идеале должен удовлетворять 70 % спроса. Однако достижение данного уровня требует быстрого роста внутреннего производства в 3,5 и более раза.
Задачи импортозамещения лекарств провозглашены в ФЦП «Развитие фармацевтической и медицинской промышленности Российской Федерации на период до 2020 года и дальнейшую перспективу», предусматривающей финансирование создания новых производственных площадок.
Существенные коррективы в процесс импортозамещения внесло вступление России в ВТО (Федеральный закон «О ратификации Протокола о присоединении Российской Федерации к Марракешскому соглашению об учреждении Всемирной торговой организации от 15 апреля 1994 г.» № 126-ФЗ от 21 июля 2012 г.), значительно осложнившее реализацию курса на самообеспечение страны фармацевтической продукцией.
К дезорганизующим процесс импортозамещения лекарств факторам можно отнести: недоработанность законодательной базы, приводящая к срыву поставленных в ФЦП целей, затягиванию сроков регистрации новых ЛС и отсутствию инструментов для защиты прав отечественных производителей на национальном и международном уровнях, недостаточность финансирования ФЦП, отсутствие действенных механизмов стимулирования разработки и производства лекарств в России на фоне падающих импортных пошлин и др.
Таким образом, на основе проведенного исследования можно сделать вывод о несоответствии требований резко изменившейся текущей внешне- и внутриэкономической ситуации реально осуществляемым действиям, отсутствии системного подхода к импортозамещению лекарств с целью доведения уровня внутреннего производства хотя бы до заявленного в ФЦП.
Вместе с тем перспективы развития отрасли связаны с развитием государственного регулирования, которое можно разделить на организационно-административное и экономическое направления. Первое предполагает создание системы долгосрочного планирования потребности в лекарственной продукции и транспорентной системы ее госзакупок; воссоздание системы фармацевтического контроля, упорядочение процедур сертификации и регистрации фармпродуктов российского производства, активное взаимодействие профессиональных ассоциаций и союзов, второе - стимулирование инвестиционной деятельности в области национального производства лекарственных препаратов, государственное экономическое участие в процессах разработки инновационных лекарств, дальнейшее развитие кластерного подхода в для локализации фармпроизводства.
Рецензенты:
Бурланков С.П., д.э.н., профессор, начальник управления подготовки кадров высшей категории ФГБОУВПО «Мордовский государственный университет имени Н.П. Огарева», г. Саранск;
Имяреков С.М., д.э.н., профессор кафедры мировой экономики и менеджмента Саранского кооперативного института (филиала) АНО ОВО Центросоюза РФ «Российский университет кооперации», г. Саранск.



