В настоящее время наибольшую актуальность приобрела проблема защиты воздушного бассейна от различных примесей. Среди загрязняющих компонентов особое место занимают оксиды азота. Источники выбросов моно- и диоксидов азота очень разнообразны. Превышения фоновых концентраций вызываются деятельностью химических предприятий, энергетических установок и возрастающим потоком автотранспорта.
Большое количество выбросов в атмосферу оксидов азота формируется при горении различных видов топлива. Оксиды азота в этом случае образуются в основном за счет окисления молекулярного азота воздуха.
В химической промышленности источниками выбросов оксидов азота являются установки производства азотной кислоты, денитрации и концентрирования серной кислоты.
Среди способов очистки отходящих газов от оксидов азота условно можно выделить три основные группы: окислительные, восстановительные и сорбционные методы.
Окислительные методы применяют для очистки отходящих газов, содержащих примеси оксида азота (II), для перевода его в более реакционноспособное соединение – оксид азота (IV) или в другие соединения. В качестве окислителей используют кислород, озон, бихромат калия, перманганат калия, перекись водорода, азотную кислоту. Однако для очистки больших объемов газов, например дымовых газов ТЭЦ, требуется значительный расход окислителей, относительно малодоступных и дорогостоящих, что сразу ставит вопрос об экономической целесообразности процесса очистки.
Восстановительные методы основаны на использовании восстанавливающих агентов, позволяющих переводить оксиды азота в элементарный азот. Они подразделяются на термические каталитические и некаталитические методы. Термическое разложение требует высоких температур нагрева газа-носителя (6000–10000 °С), что приводит к дополнительным энергетическим затратам. Каталитическая очистка газов от оксидов азота достаточно эффективна (степень очистки достигает 98–99,9%). В качестве катализаторов используют редкие металлы, которые очень дороги, и им необходима тонкая доочистка газов от загрязняющих примесей и каталитических ядов.
Некаталитические методы более дешевые по сравнению с каталитическими, но они требуют больших расходов восстановителей. И при их применении необходимо решать проблему утилизации побочных продуктов. Более простыми и доступными являются сорбционные методы очистки дымовых газов от оксидов азота. Абсорбционная очистка, в отличие от каталитической, практически не зависит от колебаний концентраций примесей в газе, не требует применения высоких температур и дополнительной очистки газов от сопутствующих примесей. Поэтому в настоящей работе изучается возможность применения абсорбционной очистки с использованием жидких отходов производства метилдиэтаноламина в качестве сорбента оксидов азота из газовых выбросов.
Цель работы
Изучение абсорбционной способности кубовой жидкости производства метилдиэтаноламина (МДЭА), используемой для поглощения оксидов азота (NO и NO2).
Методика исследования
Сорбционную способность кубовой жидкости производства МДЭА определяли в статических условиях. Схема установки представлена на рисунке 1.
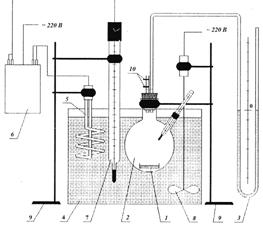
Рис. 1. Схема экспериментальной установки:
1 – емкость с навеской поглотителя; 2 – реакционная колба; 3 – манометр; 4 – термостат; 5 – нагревательный элемент; 6 – термореле; 7 – контактный термометр; 8 – мешалка; 9 – штатив; 10 – зажим.
Исходную газовую смесь вводили с помощью медицинского шприца в реакционную колбу 2, в которой находилась емкость 1 с навеской поглотителя – кубовым остатком производства МДЭА. Температурный режим поддерживали термостатом, снабженным контактным термометром, нагревательным элементом 10. Температуру в реакторе поддерживали с помощью термостата 4, состоящего из нагревательного элемента 5, термореле 6, контактного термометра 7 и мешалки 8. Изменение давления в реакционной колбе контролировали с помощью жидкостного манометра 3. Рабочую газовую смесь получали смешением концентрированного оксида азота (II) с азотом и воздухом для получения диоксида азота. Прекращение изменения показаний манометра свидетельствовало об окончании процесса поглощения оксидов азота.
Пробы газа для проведения анализа на содержание оксидов азота отбирали из реактора-абсорбера и с помощью медицинского шприца. Концентрацию оксидов азота в газовой фазе определяли фотометрическим методом с использованием сульфосалициловой кислоты, а также поглощением раствором NaOH с последующим титрованием раствором соляной кислоты в присутствии индикатора – метилового красного.
Анализ поглотительного раствора проводили после проведения эксперимента путем титрования 0,1 н раствором серной кислоты. Проведенные анализы позволяли определить поглотительную способность кубовой жидкости производства МДЭА.
Результаты исследования
Анализ газовой фазы показал уменьшение концентрации оксидов азота в реакторе с течением времени. Достигнув состояния насыщения, кубовая жидкость, помещенная в реактор, перестает поглощать оксиды азота, и их концентрация в газовой фазе остается величиной постоянной. Этот момент определяет окончание опыта. Опыты проводили при различных начальных концентрациях.
Полученные зависимости изменения концентрации оксида азота (IV) во времени представлены на рисунке 2. Начальная концентрация диоксида азота в газовой фазе составляла 0,4 и 0,8 ммоль/л, а поверхность контакта фаз – 0,33 и 5,73 см2.
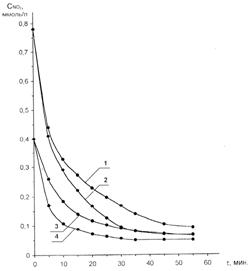
Рис. 2. Зависимость текущей концентрации NO2 при взаимодействии с кубовым остатком МДЭА при температуре опыта 20 °С и поверхности контакта фаз (S, см2): для № 1 и № 3 – 0,33; для № 2 и № 4 – 5,73.
Из рисунка 2 видно, что с увеличением времени взаимодействия текущая концентрация оксида азота (IV) уменьшается, причем скорость такого снижения выше для газа с большим начальным содержанием оксидов азота. Для всех кривых характерно наиболее интенсивное поглощение оксидов азота в течение первых 10 минут проведения опыта, затем скорость заметно снижается, достигая нулевого результата, соответствующего достижению системой равновесного состояния и полного насыщения поглотителя. Были проведены опыты при повышенных температурах. Зависимости изменения текущей концентрации диоксида азота во времени при температурах 40 и 60 ׄС представлены на рисунке 3. Кривые № 1 и № 3 получены при температуре 40 °С, а № 2 и № 4 – при 60 °С.
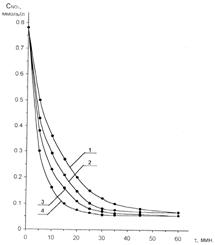
Рис. 3. Зависимость текущей концентрации NO2 при взаимодействии с кубовым остатком МДЭА при температурах опыта 40 и 60 °С и поверхности контакта фаз (S, см2): для № 1 и № 3 – 0,33; для № 2 и № 4 – 5,73.
Анализируя полученные зависимости, можно удостовериться в том, что повышение температуры в данном интервале интенсифицирует процесс взаимодействия NO2 с поглотителем.
Дальнейшее повышение температуры до 120 °С приводит к появлению максимума на кривой зависимости поглотительной способности кубового остатка производства МДЭА по NO2 от температуры, представленной на рисунке 4. Этот максимум, как видно из рисунка, соответствует температуре 70 °С. Поглотительная способность раствора МДЭА равна при этой температуре 0,75 г NO2/г поглотителя (при начальном содержании NO2 – 0,4 ммоль/л). Дальнейший нагрев до 120 °С привел к снижению поглотительной способности до 0,65 г NO2/г поглотителя.
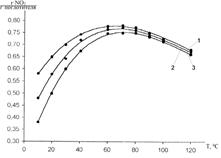
Рис. 4. Зависимость поглотительной способности кубового остатка производства МДЭА по NO2 от температуры при равновесном содержании NO2 (С, ×10-4 моль/л): № 1 – 7,8; № 2 – 5,8; № 3 – 4,0.
Количество прореагировавшего с кубовым остатком МДЭА NO2 зависит от концентрации диоксида азота в газе при температурах ниже 50 °С, что свидетельствует о протекании в данной температурной области физической абсорбции.
Таким образом, при температуре 10 °С, увеличивая концентрацию NO2 с 4·10-4 до 7,8·10-4 моль/л, наблюдаем рост поглотительной способности кубового остатка МДЭА с 0,38 до 0,58 г NO2/г поглотителя, при 20 °С - с 0,5 до 0,65 г NO2/г поглотителя, и при 30 °С - с 0,6 до 0,7 г NO2/г поглотителя (рис. 4). При температуре выше 70 °С начальная концентрация NO2 практически утрачивает свое влияние на поглотительную способность раствора МДЭА, при этом поглотительная способность монотонно начинает снижаться, что связано с уменьшением физической растворимости газа в жидкой фазе.
Хроматографическим методом установлено, что на 94% кубовая жидкость состоит из метилдиэтаноламина, по величине поглотительной способности данного раствора можно сделать вывод о том, что один моль поглотителя реагирует с двумя молями NO2, что может соответствовать протеканию процесса по реакции:
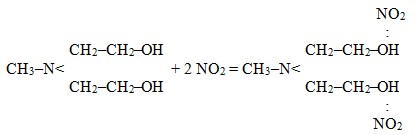
Вероятность протекания реакции подтвердили расчетом термодинамических параметров. Энергия Гиббса составила -(-588,36) кДж/моль. По экспериментальным значениям были рассчитаны кинетические параметры процесса взаимодействия NO2 с кубовой жидкостью производства МДЭА. Варьировали температуру опыта, поверхность контакта фаз и начальную концентрацию NO2.
Полученные данные показали, что повышение температуры процесса с 20 до 60 °С привело к возрастанию скорости взаимодействия NO2 с кубовой жидкостью производства МДЭА с 17,76×10-6 до 31,5×10-6 моль/(л·см2·мин) при начальной концентрации NO2 4·10-4 моль/л. Увеличение поверхности контакта фаз «жидкость - газ» с 0,33 до 5,73 см2 позволило повысить скорость процесса с 28,01×10-6 до 32,35×10-6 моль/(л·см2·мин) при том же начальном содержании NO2.
Порядок реакции, равный одному, определили по логарифмической зависимости скорости процесса от концентрации NO2 в газе. Расчеты константы скорости реакции показали ее рост с 0,039 до 0,084 (см2·мин)-1 с увеличением температуры от 20 до 60 °С.
Рассчитанная величина энергии активации составила 15,52 кДж/моль. Таким образом, было получено кинетическое уравнение, описывающее процессы взаимодействия NO2 с кубовой жидкостью производства МДЭА, которое имеет вид:
![]() ,
,
где СNO2 - текущая концентрация NO2 в газовой фазе, моль/л; С*NO2 - равновесная концентрация NO2 в газовой фазе, моль/л.
Выполненные исследования дают возможность оценить механизм взаимодействия NO2 с кубовой жидкостью производства МДЭА. В результате реакции с большой долей вероятности образуется нитрометилдиэтаноламин. Сжигание насыщенных оксидами азота растворов не приводит к выделению оксидов азота, превышающих ПДК. Оксиды азота в процессе горения восстанавливаются углеводородными радикалами, образующимися при высокой температуре. Поэтому исследуемый поглотитель можно рекомендовать для промышленной очистки отходящих газов от диоксида азота с последующей утилизацией отработанных растворов в котельных установках.
Выводы
- Предложен новый поглотитель для очистки отходящих газов от оксидов азота, представляющий собой кубовый остаток производства метилдиэтаноламина.
- Изучено взаимодействие оксидов азота с кубовым остатком производства метилдиэтаноламина в статических условиях в температурном интервале от 10 до 120 °С. Отмечено наличие максимума поглотительной способности по диоксиду азота при температуре 70 °С, соответствующее 0,75 г NO2/г поглотителя.
- Установлено протекание физической абсорбции при температуре ниже 50 °С.
- Предложен химизм взаимодействия диоксида азота с метилдиэтаноламином, подтвержденный расчетом термодинамических величин. Величина энергии Гиббса составила (-588,36) кДж/моль.
- Рассчитаны кинетические параметры процесса: скорость реакции, порядок реакции, равный единице, и энергия активации, составляющая 15,52 кДж/моль.
Рецензенты:
Ульянов В.М., д.т.н., профессор кафедры «Машины и аппараты химических и пищевых производств» ДПИ НГТУ им. Р.Е. Алексеева, г. Дзержинск.
Ксандров Н.В., д.т.н., профессор кафедры «Технология неорганических веществ» ДПИ НГТУ им. Р.Е. Алексеева, г. Дзержинск.



