Ишемическая болезнь сердца (ИБС) является одной из ведущих медико-социальных проблем мирового и национального здравоохранения, имея под собой не только высокий уровень развития сердечно-сосудистых осложнений, инвалидизации и смертности, но и прогрессивно растущие социально-экономические последствия. Последние десятилетия ознаменовались успехом в профилактике и лечении данного заболевания, немалая роль которого принадлежит широкому использованию интервенционных интракоронарных вмешательств – коронарной ангиопластики и стентирования [1]. Эндоваскулярные методы лечения в большинстве случаев обеспечивают положительные клинико-ангиографические результаты у больных острыми и хроническими формами ИБС. В то же время все большую долю в пуле коронарных пациентов стали занимать сопутствующий сахарный диабет (СД) 2 типа и метаболический синдром. Ассоциация ИБС и СД 2 типа характеризуется быстро прогрессирующим диффузным многососудистым атеросклеротическим поражением коронарного русла, с большей частотой развития хронических окклюзий, фатального и нефатального инфаркта миокарда и смерти [5]. Указанные особенности явились первоначальным основанием преимущественного использования коронарного шунтирования (КШ) в качестве реваскуляризационной терапии у данной группы пациентов, что подтверждено данными мета-анализа 10 рандомизированных контролируемых исследований, в ходе которого сравнивались КШ и баллонная ангиопластика с имплантацией голометаллических стентов (ГМС) [2]. Меньшая эффективность ГМС была обусловлена развитием внутристентовых стенозов, лежавших в основе рецидива ИБС [2]. Внедрение в практику стентов с лекарственным покрытием (СЛП), цитостатическое покрытие которых подавляет клеточную пролиферацию в месте имплантации, обеспечило достоверное снижение частоты указанных осложнений и необходимости повторных вмешательств в отдаленном периоде в случае сочетания ИБС с СД 2 типа при отсутствии влияния, как казалось, на смертность и инфаркт миокарда (ИМ) [3]. Ряд мета-анализов последних лет показал сопоставимые результаты при применении ангиопластики с использованием СЛП в сравнении с КШ [4,7,8]. В то же время замедление нормальной эндотелизации эндопротеза вследствие цитостатических свойств лекарственного покрытия и возможные тромбогенные свойства полимера увеличивают риск развития поздних тромботических коронарных осложнений, несмотря на снижение частоты повторных реваскуляризаций. Анализ клинических и морфологических причин поздних коронарных осложнений показал, что факторами риска неблагоприятного прогноза могут быть прекращение приема пациентами двойной антиагрегантной терапии, а также различные клинические состояния, способствующие гиперкоагуляции (сахарный диабет, почечная недостаточность, низкая фракция выброса и др.) [6,9]. Тем не менее выявление таких факторов по-прежнему остается актуальной проблемой, а относительно продолжительности приема двойной антиагрегантной терапии при различных сопутствующих заболеваниях нет единого мнения. Помимо этого, накопление отдаленных наблюдений показало, что СЛП в некоторых клинических ситуациях не обеспечивают эффективное подавление гладкомышечной пролиферации и снижения частоты развития рестеноза. В связи с этим по-прежнему остается актуальным статистический анализ с целью выявления факторов, увеличивающих вероятность развития рестеноза и негативно влияющих на отдаленный прогноз после коронарного стентирования.
Цель исследования: изучить отдаленные результаты коронарного стентирования и их предикторы у больных ИБС в сочетании с СД 2 типа.
Материалы и методы: в исследование были включены 172 пациента после перенесенной чрескожной коронарной ангиопластики, в ходе которой было проведено стентирование коронарных артерий. Они были распределены на 2 группы. В основную группу включено 103 больных с ИБС в сочетании с СД 2 типа (мужчин – 72, женщин – 31, средний возраст – 69,25±0,97 года). Анамнез СД 2 типа составлял от 0 до 18 лет, имея среднюю продолжительность около 9 лет. 43 (42 %) пациента находились на инсулинотерапии, остальные получали терапию пероральными антидиабетическими препаратами в виде двух- и однокомпонентной терапии. Группу сравнения составили 69 пациентов с ИБС без нарушений углеводного обмена (мужчин – 55, женщин – 14, средний возраст – 62,70±1,40 года). Критериями исключения из исследования были непереносимость АСК и/или клопидогреля; эрозивно-язвенные поражения желудочно-кишечного тракта в анамнезе; КШ в анамнезе; геморрагический синдром в анамнезе; обширное оперативное вмешательство в течение последнего месяца перед коронарным стентированием; количество тромбоцитов менее 100·109 л-1; концентрация гемоглобина менее 100 г/л; наличие острой патологии или обострения/высокой активности хронической патологии, в том числе онкологической.
В структуре обследованных, вошедших в основную группу, наблюдались нестабильная и стабильная стенокардия у 31 (30,4 %) и 50 человек (49,0 %) соответственно, не Q и Q-инфаркт миокарда у 15 (14,7 %) и 6 (5,9 %) соответственно, при этом у 13 (13 %) пациентов был отмечен рестеноз ранее имплантированного стента. В группе лиц с ИБС без нарушения углеводного обмена также преобладали пациенты с нестабильной и стабильной стенокардией – 26 (37,7 %) и 28 (40,6 %) соответственно, а не Q и Q-инфаркты миокарда наблюдались у 5 (7,2 %) и 10 (14,5 %) больных.
Всем пациентам в обеих группах выполнены исследования липидного спектра крови, мозгового натрийуретического пептида (BNP), рассчитана рСКФ по MDRD (таблица 1), а также проведена селективная коронарография (СКГ) перед интракоронарным интервенционным вмешательством, через 6 месяцев, на 1, 2, 3 и 4 годы. На основании данных исходной СКГ рассчитывался показатель шкалы SyntaxScore, который составил 13 [7;18] баллов в первой группе и 12 [7;16] баллов во второй (p=0,14).
Таблица 1
Исследуемые исходные показатели крови ( M ± m ), Me [25 %; 75 %]
|
Показатель |
1-я группа ( n = 103 ) |
2-я группа ( n = 69 ) |
p |
|
ОХС, ммоль/л |
5,26 [4,67;6,23] |
4,76[3,9;5,64] |
0,37 |
|
ХС ЛПВП, ммоль/л |
1,2±0,06 |
1,4±0,06 |
0,027 |
|
ХС ЛПНП, моль/л |
2,6±0,2 |
2,8±0,2 |
0,42 |
|
ТГ, ммоль/л |
1,65 [1,18;2,45] |
1,53[1,16;2,19] |
0,470 |
|
BNP, пг/мл |
164,4±22,05 |
121,1±19,9 |
0,010 |
|
рСКФ по MDRD (мл/мин/1,73 м2) |
55,8±2,9 |
84,8±4,6 |
0,001 |
Перед коронарной ангиопластикой и стентированием все пациенты получали нагрузочную дозу АСК (Aspisol®, Bayer Vital GmbH, ФРГ) 500 мг внутривенно и клопидогреля (Плавикс®, Sanofi Pharma Bristol-Mayers Squibb SNC, Франция) 600 мг внутрь. Интраоперационно использовался нефракционируемый гепарин 70 ЕД/кг внутривенно болюсно. 8 (7,8 %) пациентов основной группы и 6 (8,7 %) больных группы контроля в день проведения стенторования коронарных артерий получали абциксимаб (РеоПро®, Lilly, Швейцария; производитель Hospira Inc., США); упаковщик Cilag, Швейцария). Внутривенно 0,25 мг/кг болюсно (за 10–60 мин до коронарной ангиопластики), а затем инфузионно, со скоростью 10 мкг/мин в течение 12 часов. Всего пациентам в основной группе имплантировано 215 стентов (2,15±0,13), из них – 132 (61,4 %) стенты длиной менее 20 мм, которые были установлены 44 больным (42,7 %). Количество стентов длиной более 20 мм составило 83 (38,6 %), они были имплантированы 59 пациентам (57,3 %). В группе сравнения было имплантировано 166 стентов (2,41±0,2), из них 110 (66,3 %) – стенты длиной менее 20 мм, которые были имплантированы 30 больным (43,5 %). Количество стентов длиной более 20 мм составило 56 (33,7 %), они были имплантированы 39 пациентам (56,5 %). Не выявлено достоверных различий в среднем количестве установленных стентов между группами, при этом в группе сравнения достоверно чаще имплантировались стенты длиной менее 20 мм (χ2=3,65, p=0,05), в то время как у пациентов с ИБС в сочетании с СД 2 типа преобладали стенты длиной более 20 мм (χ2=27, p=0,0001). В обоих группах преобладали СЛП (79,6 % vs 75,4 %): сиролимус-покрытые (Cypher-Cordis (Johnson & Johnson, США) и Orsiro (Biotronik, ФРГ)), эверолимус-покрытые (Xience V и Xience Prime (Abbott Vascular, США), Promus и Taxus Element (Boston Scientific, США)); зотаролимус-покрытые (Resolute Integrity (Medtronic, США)). В качестве голометаллических стентов использовались PRO-Kinetic (Biotronik, ФРГ). Пациенты после коронарного стентирования в течение 12 месяцев (в случае СЛП) или 1 месяца (в случае ГМС) получали двойную дезагрегантную терапию АСК (Тромбо АСС®, Lannacher Heilmittel, Австрия) 100 мг/сутки и клопидогрель 75 мг/сутки (89 (86,4%) vs 54 (78,3 %) человек) или празугрел (Эффиент®, Eli Lilly, США) (11 (10,7%) vs 15 (21,7%) человек) 10 мг/сутки или тикагрелор (Брилинта®, AstraZeneca АВ, Швеция) 90 мг/сутки (4 (3,9 %) vs 0). Длительность наблюдения в среднем составила 4 года, в ходе которого фиксировались большие кардио- и цереброваскулярные (смерть, сердечно-сосудистая смерть, нефатальные инфаркт миокарда и инсульт, нестабильная стенокардия, нарастание класса тяжести стабильной стенокардии) и ангиографические (тромбоз и рестеноз ранее установленного стента, появление нового стеноза коронарных артерий) события. Полученные в ходе исследования результаты обрабатывались статистически общепринятыми методами статистики на компьютере IBM PC при помощи пакета прикладных программ для обработки медицинской и биологической информации «SТАTISTICA 10.0» (StatSoft Inc., США). При нормальном распределении переменных для определения различий между двумя независимыми группами использовался непарный t-критерий Стьюдента, а при непараметрическом – критерий Вилкоксона – Манна – Уитни. Различие между долями оценивали при помощи критерия χ2 в таблицах сопряженности 2×2. Для определения связи между демографическими, клиническими, лабораторными показателями использовались методы корреляционного анализа для параметрических и непараметрических критериев – критерии Пирсона и Спирмена соответственно. Достоверными считали различия и корреляции при p < 0,05. Анализ распределения промежутка времени до больших кардио- и цереброваскулярных событий в отдаленном периоде определяли при помощи кривых выживаемости по Каплану – Майеру. Анализ рисков (ожидаемой вероятности) развития отдаленных исходов эндоваскулярного лечения ИБС проводился при помощи вычисления абсолютного риска (частот развития событий в экспонированной и контрольной группах), атрибутивного и относительного риска).
Результаты и их обсуждение: наблюдаемые отдаленные исходы в сравниваемых группах пациентов отражены в таблице 2.
Таблица 2
Сравнительная оценка отдаленных исходов эндоваскулярного лечения ИБС у больных в группах сопутствующего СД 2 типа и без него
|
Показатель |
ИБС+СД 2 типа (n = 103) |
ИБС (n = 69) |
Относительный риск (OR) (95% ДИ) |
р |
|
Смерть, человек (%) |
5 (4,8%) |
2 (2,9%) |
1,71 (0,32; 9,07) |
<0,0001 |
|
Q-ИМ, человек (%) |
0 |
1 (1,4%) |
1,01 (0,99; 1,04) |
<0,0001 |
|
не-Q-ИМ, человек (%) |
3 (2,9%) |
4 (5,8%) |
0,49 (0,11; 2,25) |
<0,0001 |
|
Всего ИМ, человек (%) |
3 (2,9%) |
5 (7,2%) |
0,38 (0,09; 1,66) |
<0,0001 |
|
Нестабильная стенокардия, человек (%) |
30 (29,1%) |
9 (13,4%) |
2,33 (1,02; 5,33) |
0,0001 |
|
Нарастание функционального класса стабильной стенокардии напряжения, человек (%) |
17 (16,5%) |
8 (11,8%) |
1,48 (0,60; 3,65) |
<0,0001 |
|
Инсульт, человек (%) |
7 (6,8%) |
1 (1,5%) |
4,96 (0,60; 41,23) |
<0,0001 |
|
Тромбоз ранее установленного стента, человек (%) |
0 |
1 (1,5%) |
1,02 (0,99; 1,05) |
<0,0001 |
|
Рестеноз ранее установленного стента, человек (%) |
16 (15,5%) |
6 (8,7%) |
1,76 (0,65; 4,79) |
<0,0001 |
|
Возникновение нового стеноза, человек (%) |
30 (30,0%) |
12 (17,4%) |
1,94 (0,91; 4,14) |
0,0001 |
|
Хороший ангиографический результат, человек (%) |
54 (52,4%) |
23 (33,3%) |
2,2 (1,17; 4,15) |
0,2068 |
|
КШ, человек (%) |
1 (1%) |
2 (2,9%) |
0,32 (0,03; 3,69) |
<0,0001 |
|
Большие кровотечения, человек (%) |
1 (1%) |
0 |
0,99 (0,97; 1,01) |
<0,0001 |
В основной группе смерть наблюдалась к 4 году наблюдения у 5 (4,8 %) человек в основной группе (из них сердечно-сосудистая смерть – у 3 (2,9 %) пациентов), и 2 (2,9 %) больных в группе сравнения, из них у 1 (1,45 %) она была кардиоваскулярной природы (p<0,001). Риск развития смерти достоверно выше у больных с сопутствующим СД 2 типа, подвергнувшихся коронарной ангиопластике и стентированию (атрибутивный риск (АР) составил 1,9 %, а относительный риск (ОР) – 1,71). При этом сопутствующий СД 2 типа сопровождается увеличением АР и ОР появления новых стенозов (рисунок 1) и рестенозов ранее установленных коронарных стентов (12,6 % и 1,94, 6,8 % и 1,76 соответственно), что сопровождалось как нарастанием функционального класса стабильной стенокардии (АР – 4,7 %, ОР – 1,48), так и большей частотой развития нестабильной стенокардии (АР – 15,7 %, ОР – 2,33).
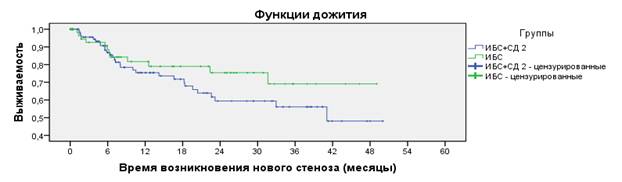
Рис.1. Сравнительная динамика развития de novo стенозов коронарного русла у больных с сопутствующим СД 2 типа и без него
В то же время у больных с ассоциацией ИБС и СД 2 типа, подвергнувшихся интракоронарному вмешательству, в 4-летнем отдаленном периоде значимо реже наблюдалось развитие нефатального ИМ (АР – -4,3 %, ОР – 0,38) и не встретился поздний тромбоз ранее установленного стента (таблица 2).
Корреляционный анализ показал зависимость развития стенозирующего процесса ранее неизмененых коронарных артерий у больных с сопутствующим СД 2 типа в течение ближайших 4 лет после ангиопластики и стентирования от исходного уровня триглицеридов крови (R=0,2, p<0,05) и уровня рСКФ (R=-0,25, p<0,05). Развитие рестеноза ранее установленных стентов положительно коррелирует с исходным количеством пораженных коронарных артерий и наличием кальциноза в них (R=0,69 и 0,26 соответственно, p<0,05), а также уровнем тропонина I через 24 часа после интракоронарного вмешательства (R=0,37, p<0,05). Несомненна роль рестеноза в развитии нестабильной стенокардии и ИМ в отдаленном периоде у данной группы пациентов (R=0,31 и 0,26 соответственно, p<0,05), в то время как вновь образованные ангиографически значимые стенозы лежат в основе нестабильной стенокардии и нарастания функционального класса стабильной стенокардии напряжения (R=0,35 и 0,24 соответственно, p<0,05). К предикторам развития нефатального ИМ в течение ближайших 4 лет относятся снижение фракции выброса левого желудочка (R= -0,42, p<0,05), развитие острого и подострого тромбоза стента при стентировании (R=0,43, p<0,05), хроническая окклюзия коронарных артерий (R=0,23, p<0,05), отсутствие использования β-адреноблокаторов в плановой терапии основного заболевания и его осложнений (R=-0,32, p<0,05).
К предикторам развития смерти в течение ближайших 4 лет следует отнести исходное повышение уровня BNP (R=0,48, p<0,05), жизнеопасные нарушения ритма в анамнезе, потребовавшие длительной терапии амиодароном (R=0,38, p<0,05), повышение параметров индуцированной арахидоновой кислотой и АДФ агрегации тромбоцитов (R=0,32 и 0,28 соответственно, p<0,05), наличие ИМ в анамнезе (R=0,28, p<0,05), исходных тахикардии в покое и выявлением тропонина I перед эндоваскулярным вмешательством (R=0,22 и 0,21 соответственно, p<0,05).
При анализе влияния адекватной сопутствующей антидиабетической терапии на отдаленные исходы эндоваскулярного лечения ИБС у больных с СД 2 типа установлено, что большинство классов используемых препаратов, включая инсулин, не оказывают какого-либо воздействия на них, за исключением более частого развития нестабильной стенокардии в случае применения ситаглиптина (R=0,37, p=0,036) (ОР, 4,09, 95% ДИ, 1.01-16.57).
Заключение
Наличие сопутствующего сахарного диабета 2 типа утяжеляет отдаленный прогноз у больных ИБС, подвергнувшихся эндоваскулярной терапии за счет прогрессирования многососудистого атеросклеротического поражения коронарных артерий, приводящее к развитию нестабильной стенокардии и нарастания функционального класса стабильной стенокардии напряжения. С учетом выявленных предикторов неблагоприятного прогноза значимое место во вторичной профилактике неблагоприятного клинико-ангиографического исхода и сердечно-сосудистых осложнений в данной группе пациентов должны занимать адекватные антитромбоцитарная и антиишемическая терапия с использованием высокоселективных β-адреноблокаторов в структуре последней, а также коррекция гипертриглицеридемии.
Рецензенты:
Варварина Г.Н., д.м.н., профессор, зав. кафедрой пропедевтики внутренних болезней, ГБОУ ВПО «Нижегородская государственная медицинская академия» Минздрава России, г. Нижний Новгород;
Королёва Л.Ю., д.м.н., профессор кафедры госпитальной терапии им. В.Г. Вогралика, ГБОУ ВПО «Нижегородская государственная медицинская академия» Минздрава России, г. Нижний Новгород.



