Основным источником питьевого водоснабжения на территории Томской области являются подземные воды. Качество подземных вод в естественных природных условиях по ряду показателей не отвечает нормативным требованиям. Основной примесью, влияющей на качество подземных вод, является железо, обогащение которым происходит вследствие выщелачивания железистых пород [8].
Ионы железа характеризуются поливалентностью и могут находиться в различных формах: Fe2+ и Fe3+. В подземных водах ионы железа преимущественно находятся в виде Fe2+, концентрация которого может достигать 15 мг/л, ввиду большого содержания свободного диоксида углерода и отсутствия окислителей. Соединения железа трехвалентного, согласно справочным данным [6], обладают меньшей растворимостью, чем соединения железа Fe2+, поэтому в технологиях водоподготовки железосодержащих подземных вод процесс окисления является определяющим. В настоящее время в качестве окислителей используют кислород воздуха, перманганат калия, хлор, пероксид водорода и озон [7]. На сегодняшний день наиболее сильным окислителем, широко используемым на практике, является озон, поскольку может быть использован для обеззараживания, обесцвечивания, дезодорации воды, для удаления соединений железа и марганца. Проведенные ранее исследования [1,3,4] показали, что озон обладает высоким бактерицидным и вирулицидным действием, высокой степенью окисления органических веществ. Озон не придает воде запаха и привкуса. При этом он обладает сильными коррозионными свойствами и токсичен [2], что следует учитывать при использовании озона для решения практических задач.
Целью настоящей работы является определение кинетических параметров реакций окисления железа кислородом воздуха и озоном на реальных подземных водах.
Материалы и методы исследования
Определение кинетических параметров реакции окисления ионов Fe2+ на реальных подземных водах является сложным ввиду нестабильности химического состава воды. Поэтому для получения достоверной информации, работу выполняли на модельных растворах, аналогичных составу природных вод.
Модельные растворы готовили из соли сульфата Fe2+ с концентрацией ионов Fe2+ равной 10 мг/л. Приготовленные растворы подвергались озонированию и аэрированию кислородом воздуха. Для получения озона использовали малогабаритный озонатор барьерного типа с производительностью 1 г/ч. Для определения концентрации озона в водной среде использовали титриметрический метод согласно ГОСТ 18301-72. Для получения кислорода использовали атмосферный воздух. Озон и кислород с помощью насоса подавали в колбу Рихтера, содержащую модельный раствор. Для лучшего растворения озона или кислорода использовали распылитель в виде керамического фильтра с диаметром пор около 120 мкм, соединенный трубкой с озонатором или компрессором воздуха.
Содержание общего железа в растворе определяли фотоколориметрически согласно ПНДФ14.1:2:4.50-96, марганца согласно ГОСТ 4974-72, ионы аммония согласно ГОСТ 4192-82 п.3, хлорид-ион согласно ГОСТ 4245-72, сульфат-ион согласно ГОСТ 31940-2012, нитрат-ион согласно ПНДФ 14.1:2:4.4-95 и кремния по РД 52.24.433-2005 с помощью прибора КФК-3. Концентрацию ионов железа (II) определяли фотоколориметрически согласно ГОСТ 4011-72 с о-фенантролином. Общую жесткость и перманганатную окисляемость (ПО) определяли титриметрически согласно ГОСТ 31954-2012 и ПНДФ 14.1:2:4.154-99 соответственно.
Наличие бактерий определяли титрационным методом с использованием среды Кода согласно ГОСТ 24849-81.
Результаты и их обсуждение
Для определения химического состава подземных вод Томской области был проведен мониторинг, результаты которого представлены в табл. 1.
Таблица 1
Химический состав подземных вод Томской области
|
Источник |
Жобщ ммоль/л |
Feобщ мг/л |
Mn2+ мг/л |
CI- мг/л |
SO42- мг/л |
NH4+ мг/л |
Si, мг/л |
ПО, мгО2/л |
|
п. Тимирязево (Томский район) |
2,4 |
4,0 |
0,46 |
36,5 |
29,2 |
1,56 |
6,3 |
2,2 |
|
п. Зоркальцево (Томский р-н) |
4,4 |
5,6 |
0,36 |
0,2 |
1,16 |
1,44 |
9,4 |
0,9 |
|
п. Нелюбино (Томский р-н) |
6,2 |
5,2 |
0,42 |
2,4 |
1,16 |
1,34 |
14,3 |
2,0 |
|
п. Оськино (Томский р-н) |
2,2 |
4,3 |
0,62 |
н/о |
5,7 |
1,25 |
н/о |
2,2 |
|
п. Богашево (Томский р-н) |
6,4 |
1,64 |
0,40 |
12,9 |
9,6 |
0,35 |
н/о |
1,3 |
|
п. Кисловка (Томский р-н) |
5,3 |
5,0 |
0,24 |
19,2 |
2,4 |
0,3 |
8,9 |
6,4 |
|
п.Ср. Нюрольское (Каргасокский р-н) |
6,2 |
3,5 |
0,14 |
26 |
5,5 |
н/о |
17,0 |
4,9 |
|
с.Тунгусово (Молчан-й р-н) |
7,1 |
4,0 |
0,11 |
15,5 |
н/о |
0,34 |
12,2 |
4,1 |
|
п. Комcомольск (Первомайс-й р-н) |
6,9 |
12,9 |
0,28 |
н/о |
8,6 |
0,15 |
14,6 |
2,0 |
|
п. Шегарка (Шегарский р-н) |
7,0 |
2,15 |
0,11 |
12,3 |
5,5 |
0,35 |
18,3 |
5,5 |
|
п. Белый Яр (Верхнекетс-й р-н) |
2,7 |
9,55 |
0,47 |
34,5 |
21,2 |
н/о |
16,5 |
4,9 |
|
ПДК* |
7,0 |
0,3 |
0,1 |
350 |
500 |
0,5 |
10,0 |
5,0 |
ПДК* – СанПиН 2.1.4.1074 – 01 Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества.
Как видно из таблицы 1, практически во всех водах наблюдается превышение НДК по железу и марганцу. Для образования нерастворимых соединений типа Fe(OH)3 в водной среде проводили процесс окисления. В качестве окислителей использовали озон и кислород воздуха. На первом этапе работы использовали озон.
Окисления железа озоном в водной среде описывается реакцией:
4 Fe2+ + ![]() О3 + 2 Н2О → 4 Fe(OH)3↓ (1)
О3 + 2 Н2О → 4 Fe(OH)3↓ (1)
Скважинные воды Томской области, отобранные с глубины 80–120 м, имеют температуру не выше 9![]() С. В связи с этим процессы окисления железа озоном в модельных растворах изучены как при температуре 9
С. В связи с этим процессы окисления железа озоном в модельных растворах изучены как при температуре 9![]() С, так и 20
С, так и 20![]() С. Экспериментальные результаты представлены на рис. 1.
С. Экспериментальные результаты представлены на рис. 1.
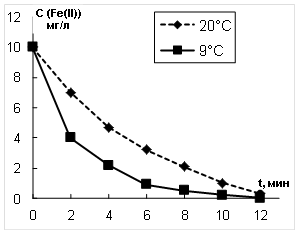
Рис. 1. Изменение концентрации Fe(II) от времени озонирования
Из полученных экспериментальных данных была определена скорость окисления ионов Fe2+ при озонировании при 9![]() С и 20
С и 20![]() С. Для расчета скорости окисления использовали формулу:
С. Для расчета скорости окисления использовали формулу:![]() где ΔС-изменение концентрации в единицу времени, моль/литр; Δt – время окисления, секунды.
где ΔС-изменение концентрации в единицу времени, моль/литр; Δt – время окисления, секунды.
Обработка полученных кинетических зависимостей, представленных на рис.1 в координатах С=f(t), позволила установить, что они являются экспоненциальными и описываются уравнением 1 порядка:
С=С∙e-k∙t (2)
где С0 и С – начальная и текущая концентрация ионов Fe2+ моль/л, k – эффективная константа скорости, с-1, t – время окисления, с.
Из полученного уравнения (2) были рассчитаны эффективные константы скорости окисления ионов Fe2+ озоном. Использование эффективных констант скорости объясняется тем, что процесс окисления ионов Fe2+ в реальных водах является многостадийным и на данном этапе исследований механизм этого процесса не рассматривается.
Результаты расчетов представлены в табл. 2.
Таблица 2
Кинетические параметры реакций окисления ионов Fe2+ озоном и кислородом воздуха
|
Вид воздействия |
T, °C |
v моль/л∙с |
Константы скорости, с-1 |
|
O3 |
9 |
8,2∙10-7 |
5,8∙10-3 |
|
20 |
4,4∙10-7 |
3,3∙10-3 |
|
|
O2 |
9 |
2∙10-8 |
1,9∙10-4 |
|
20 |
1∙10-8 |
0,7∙10-4 |
Анализ результатов, приведённых в таблице 2, показывает, что при озонировании скорость окисления озоном при 20 0С оказалась ниже, чем при 9 0С. Это объясняется тем, что при 9 0С растворимость озона выше, чем при 20 0С [6].
Для сравнения эффективности окисления модельного раствора озоном и кислородом воздуха на втором этапе работы в качестве окислителя использовали кислород воздуха. Окисление ионов железа Fe2+ кислородом воздуха можно представить следующей реакцией:
4 Fe2+ + О2 + 2 Н2О → 4 Fe(OH)3↓ (3)
На рис. 2 приведены кинетические зависимости изменения концентрации ионов Fe2+ от времени аэрирования.
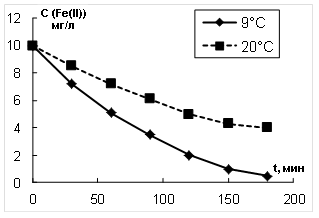
Рис. 2. Изменение концентрации Fe(II) от времени аэрирования
Рассчитанные скорости окисления и эффективные константы скорости окисления ионов Fe2+ кислородом воздуха приведены также в таблице 2. Сравнение результатов, приведенных в таблице 2, показывает, что скорость окисления ионов Fe2+ озоном выше, чем при окислении кислородом воздуха при исследованных температурах.
Полученные результаты позволили рассчитать энергию активации процесса окисления озоном и кислородом воздуха. Энергия активации процесса аэрации составила 56,1 кДж/моль; а процесса озонирования 28,8 кДж/моль. Полученные значения энергий активации говорят о том, что процесс окисления ионов Fe2+ протекает в диффузионной области, следовательно, скорость процесса будет определяться диффузией молекул кислорода или озона к ионам Fe2+. Для увеличения эффективности процесса окисления целесообразно использовать перемешивание. В технологиях водоподготовки для более интенсивного перемешивания используют различного типа эжекторы.
Эффективность процесса озонирования была исследована на водоочистной станции поселка Кисловка (Томский район). Исходный состав воды приведен в таблице 1. Воду озонировали в течение 10 минут. Указанное время было определено экспериментально.
После озонирования воду пропускали через песчаный фильтр. Доза озона составляла 5мг/л. В таблице 3 представлены результаты по изменению некоторых показателей подземной воды п. Кисловка при обработке ее озоном.
Таблица 3
Результаты анализа воды на водоочистной станции п. Кисловка
|
Показатели качества воды |
Feобщ. , мг/л |
Fe2+, мг/л |
Mn, мг/л |
NH+4, мг/л |
ПО, мгО2/л |
NO3–, мг/л |
|
До озонирования |
5,0 |
3,86 |
0,24 |
0,3 |
6,4 |
0,31 |
|
После озонирования |
0,12 |
0,10 |
0,09 |
0,49 |
2,6 |
0,69 |
|
ПДК |
0,3 |
0,3 |
0,1 |
0,5 |
5,0 |
45,0 |
Как видно из таблицы 3, озонирование приводит, практически, к полному удалению соединений железа, уменьшению концентрации ионов марганца и незначительному увеличению концентрации NH4+ и NO3-, не превышающих ПДК. Образование азотсодержащих соединений сопровождает процесс озонирования в случае получения озона из кислорода воздуха. На основании полученных экспериментальных результатов, для увеличения эффективности процесса окисления рекомендуется проводить озонирование воды перед фильтрацией.
Одним из преимуществ обработки воды озоном в отличие от кислорода является его способность обеззараживать воду. Ранее в работах [3, 4] при изучении влияния различных дезинфекторов на окислительно-восстановительные ферменты кишечных палочек было установлено, что озон сильнее угнетает бактерии, чем хлор. При проведении экспериментов по обработке озоном сточных вод п. Кисловка, контроль за бактериями осуществляли сигнальным методом с использованием среды Кода. Результаты приведены в табл. 4.
Таблица 4
Зависимость наличия бактерий от времени озонирования
|
Среда Кода |
Исходная вода |
После озонирования |
||||
|
τ = 5 мин. |
τ = 7 мин. |
τ = 10 мин. |
τ = 12мин. |
τ = 20 мин. |
||
|
Окраска среды |
Желтая через 7 часов |
Желтая через 10 часов |
Желтая через 12 часов |
Желтая через 21 часов |
Зеленая |
Зеленая |
|
Наличие бактерий |
+ |
+ |
+ |
+ |
- |
- |
Как видно из таблицы 4, наличие бактерий наблюдается в исходной воде и в воде, озонированной до 10 минут включительно, следовательно, необходимое время контакта озона с водой должно быть больше 10 минут. На основании этих данных можно рекомендовать – проводить дезинфекцию сточных вод п. Кисловка методом озонирования.
Выводы
- Определены кинетические параметры реакции окисления ионов Fe2+ кислородом при 9 оС и при 20 оС, которые составили 2∙10-8 моль/л∙с и 1∙10-8 моль/л∙с соответственно и озоном, которые составили 8,2∙10-7 моль/л∙с и 4.4∙10-7 моль/л∙. Энергии активации процесса аэрации и озонирования составили 56,1 кДж/моль и 28,8 кДж/моль соответственно.
- На примере подземной воды п. Кисловка показана эффективность использования озона для снижения концентрации ионов железа, марганца, органических веществ и для улучшения микробиологических показателей. Определено время, необходимое для дезинфекции озоном, которое составило 12 минут.
Рецензенты:
Коробочкин В.В., д.т.н., профессор, Федеральное агентство по образованию, ФГАОУ ВО «Национальный исследовательский Томский политехнический университет», г. Томск;
Бакибаев А.А., д.х.н., профессор, Федеральное агентство по образованию, ФГАОУ ВО «Национальный исследовательский Томский политехнический университет», г. Томск.



