На простой вопрос: «А для чего в живых клетках нужна мембрана?» можно однозначно дать столь же простой ответ: «А без мембраны не было бы не только самой клетки, но и жизни». Действительно, мембрана отделяет одну клетку от других, делает ее самостоятельной, ограждает от внешней среды, разделяет внутриклеточные органоиды на отдельные составляющие, тем самым предупреждая свободное движение воды и растворенных веществ из цитоплазмы в них и обратно. С мембраны начинается транспорт веществ в клетку, генерирование потенциалов действий, контакт одной клетки с другой и много другое. Мембрана поддерживает трансмембранный градиент веществ и разницу электрического потенциала, а, благодаря наличию на ней многочисленных рецепторов и антигенов, воспринимающих гормоны, медиаторы и другие биологически активные вещества, она способна менять метаболическую активность клетки и обеспечивает проявлений специфических иммунных ответов. Одним словом, без клеточной мембраны нельзя обойтись и изучение ее состояния остается актуальной задачей, особенно при меняющихся условиях окружающей клетки среды и при воздействии различных патогенных факторов.
В исследованиях, проводимых на крысах, с изучением перекисного окисления липидов и антиоксидантной защиты при гипер- и гипокальциемиях было показано усиление процесса пероксидации липидов и ослабление антиоксидантной защиты как при повышении, так и снижении уровня кальция в крови [3,4]. Эти данные не противоречат результатам других авторов, отмечающих, что активные формы кислорода вызывают накопление ионов кальция в цитоплазме, стимулирую фосфорилирование белков, а снижение или блокада их антиоксидантами уменьшает эффекты факторов роста клеток, цитокинов, инсулина, паратирина и витамина D3 [1,8,9]. Так как процесс окисления липидов оказывает влияние на осмотическую резистентность мембран эритроцитов (как свойство мембранпротивостоять различным разрушительным воздействиям), мы решили провести соответствующие исследования в условиях различного кальциевого гомеостазиса.
Цель настоящей работы было изучение осмотической резистентности мембран эритроцитов в зависимости от концентрации кальция в крови, в частности при экспериментальных гипер- и гипокальциемиях, и выяснение степени корреляционной связи с перекисным окислением липидов и антиоксидантной защитой.
Материалы и методы исследований. Исследования проводились на 30-и крысах линии Вистар, разделенных на три группы, по десять в каждой: интактные (контроль); с гиперкальциемией, создаваемой путем ежедневного, в течение двух недель, перорального введения витамина D в виде зарегистрированного аптечного препарата «Аквадетрим» (Польша) в дозе 10 000 МЕ/100г, что составляло 1 мл, к которому добавляли столько же водопроводной воды с целью введения препарата без потерь, но, при этом, не создавать водной нагрузки; с гипокальциемией, создаваемой оперативным удалением околощитовидных желез после того, как крысам внутрибрюшинно водили 0,1-0,15 мл золетила (Zoletil, Франция) и производили воротникообразный разрез в шейной области, выделяя щитовидную железу, в толще которой по обе стороны от срединной доли находили околощитовидные железы и выжигали их термокаутером.
Во время проведения экспериментов животные находились в лабораторном виварии, имея постоянный доступ к воде и пище, которая соответствовала стандартному рациону (злаковые, кукуруза, овощи, яйца), освещение было без прямых попаданий солнечных лучей и немного затемнено, то есть приближено к естественному для грызунов. В день опытов за 30-40 минут до их начала вода из клеток убиралась, что позволяло сохранить водный баланс. Содержание животных и постановка на них опытов проводились в соответствии с приказом Минздравсоцразвития России № 708н от 23 августа 2010 года «Об утверждении Правил лабораторной практики».
У всех крыс с гиперкальциемией кровь брали на следующий день после двухнедельного введения аквадетрима, а с удаленными паращитовидными железами – через 4-5 недель после операции (как времени необходимого для развития гипокальциемии), когда отмечалась судорожная готовность как наиболее характерный признак снижения содержания кальция в крови. Забой всех животных осуществлялся после предварительной инъекции золетила. В крови крыс спектрофотометрически (UNICO 2000, США) определяли содержание общего кальция, основанного на методе Radin, Gramza с помощью эриохрома синего [7] и осмотическую стойкость мембран эритроцитов [5], вносимых в образцы с разным объемным содержанием изотонического и гипертонического растворов хлористого натрия и мочевины. Среди значительного количества методик определения осмотической стойкости эритроцитарных мембран в растворах, где уменьшается содержание хлористого натрия с 0,9%, мы предпочли методику с мочевиной, которая легко проходит через мембраны клеток, и, поскольку она осмотически активна, за ней устремляется вода, приводя к чрезмерной гидратации и, как следствие, разрыву мембраны, чему также способствует и денатурирующее действие мочевины на белки в результате разрушения решетки гидратов и уменьшения стабилизирующего действия, с одновременным ослаблением гидрофобных взаимодействий [2].
О состоянии перекисного окисления липидов судили по накоплению промежуточных, в частности первичных (гидроперекиси в плазме крови) и вторичных (малоновый диальдегид в мембране эритроцитов) липидных радикалов в остатках полиненасыщенных жирных кислот, а об антиоксидантной системе – по активности внутриклеточных ферментов – гемсодержащей каталазы, способной восстанавливать перекись водорода до воды, и супероксиддисмутазы [1]. Показатели перекисного окисления липидов и ферменты антиоксидантной защиты определялись спектрофотометрически по общепринятым методикам [5,7].
Полученные результаты статистически обрабатывались с применением параметрического метода сравнения средних величин, степень достоверности оценивалась по t-критерию Стьюдента, а при сопоставлении двух показателей использовали коэффициент линейной корреляции (r) Пирсона.
Полученные результаты и их обсуждение. Определение содержания общего кальция в плазме крови крыс, ежедневно, в течение двух недель, получавших аквадетрим в дозе 10 000 МЕ/100г, выявило его достоверное (р<0,01) повышение с 2,28±0,14 ммоль/л (контроль) до 3,12±0,34 ммоль/л, а у крыс с удаленными околощитовидными железами, наоборот, отмечалось достоверное (р<0,05) снижение до 1,84±0,15 ммоль/л.
Изучение осмотической резистентности мембран эритроцитов у крыс интактной, гипер- и гипокальциемических групп показало, что разрушенных эритроцитов в 5,0 мл раствора №1, состоящего из 40,0 мл 1,8% раствора мочевины и 60,0 мл 0,9% хлористого натрия у крыс контрольной группы было 2,48±0,16%, у гиперкальциемических – 3,41±0,28% и 3,59±0,33% у гипокальциемических. В образце раствора №2 (45,0 мл мочевины и 55,0 мл хлористого натрия) этот показатель соответственно был 4,75±0,28%, 7,08±0,55% и 7,33±0,42%. Процент эритроцитов, у которых были разрушены мембраны при их внесении в растворы № 3, 4, 5 и 6, в каждом из которых на 5,0 мл увеличивалось содержание гипертонического раствора мочевины, а хлористого натрия, наоборот, на столько же снижалось, неуклонно увеличивалось, и графически это выглядело как показано на рисунке 1. Раствор №7, в котором абсолютно все внесённые эритроциты разрушались, состоял только из гипертонического раствора мочевины и расчеты строились, исходя из того, что показатели оптической плотности в этом образце принимались за 100,0%, поэтому, конечная точка на графике, независимо от условий опытов, была одна.
Из полученных результатов видно, что особых отличий стойкости эритроцитов, полученных у контрольных и экспериментальных крыс в растворах №1, 2 и 6 нет. Это можно объяснить тем, что эритроциты в первых двух могут еще противостоять разрушающему действию мочевины, а в шестом образце (в результате превалирующего содержания мочевины) процент гемолиза как нормальных, так и ослабленных примерно одинаков. Достоверные отличия (р<0,05) начиная с раствора №3, с максимальным (р<0,01) отличием в образцах с раствором №4, состоящего из 55,0 мл мочевины и 45,0 мл физраствора, что можно объяснить тем, что эритроциты с нормальной стойкостью мембран способны еще оказывать противодействие мочевины, а с ослабленной резистентностью уже начинают в большей степени разрушаться.
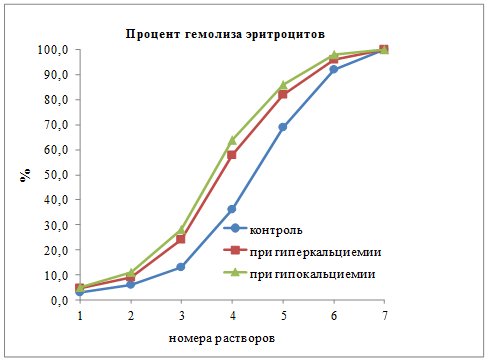
Рис. 1. Осмотическая стойкость мембран эритроцитов у крыс интактных, с гипер-и гипокальциемией по проценту гемолиза
Таким образом, повышение и снижение содержания кальция в плазме крови крыс, вызванные двухнедельным введением аквадетрима и удалением паращитовидных желез, ослабляет осмотическую стойкость мембран эритроцитов, увеличивая процент гемолизированных красных кровяных телец.
Так как в проведенных нами ранее исследованиях [3,4] было показано усиление пероксидации липидов (по повышению содержания гидроперекисей и малонового диальдегида), с одновременным ослаблением антиоксидантной защиты (по активности каталазы и супероксиддисмутазы) в условиях гипер- и гипокальциемии, создаваемые на крысах введением аквадетрима в аналогичной дозе и удалением паращитовидных желез, то в настоящей работе мы не ставили цель повторного подтверждения этого факта. Но, так как изменение осмотической стойкости мембран эритроцитов связано с перекисным окислением липидов и антиокислительной защитой, то мы решили провести корреляционный анализ взаимосвязи осмотической резистентности мембран эритроцитов с этими параметрами, а сравнивать результаты, полученные в разное время не корректно, и для правильной интерпретации корреляционной зависимости необходимо сопоставлятьданные по каждому животному. Поэтому, у всех 30-и крыс, задействованных в этом варианте исследований, определяли и осмотическую резистентность мембран эритроцитов, и продукты окисления липидов с активностью антиоксидантных ферментов. Корреляционный анализ проводили сопоставляя результаты при внесение эритроцитов в раствор №4, когда процент гемолизированных эритроцитов у контрольных крыс составлял 36,6±1,28%, у гиперкальциемических 59,4±3,15% (р<0,01), а у крыс с удаленными паращитовидными железами – 62,8±3,84 % (р<0,01).
Определение показателей пероксидации липидов выявило достоверное повышение содержания гидроперекисей и малонового диальдегида, с одновременным ослаблением активности ферментов антиоксидантной защиты как у гиперкальциемических, так и гипокальциемических крыс (табл.1).
Таблица 1
Содержание гидроперекисей и малонового диальдегида, активность каталазы и
супероксиддисмутазы у крыс интактных и с гипер-и гипокальциемией
|
Условия опытов на крысах |
Стат. показатели |
Гидро-перекиси (мкмоль/л) |
Малоновый диальдегид (мкмоль/л) |
Каталаза (10-4 МЕ/1г Hb) |
Супероксид-дисмутаза (ед. ингибир.) |
|
Интактные (контроль, n=10) |
M±m |
3,89±0,35 |
24,65±2,25 |
6,88±0,41 |
59,83±3,66 |
|
Гиперкальциемические (n=10) |
M±m p |
8,45±0,92 <0,001 |
49,81±5,08 <0,001 |
4,65±0,51 <0,001 |
40,52±4,18 <0,001 |
|
Гипокальциемические (n=10) |
M±m p |
7,73±0,84 <0,001 |
44,33±3,84 <0,001 |
5,05±0,47 <0,002 |
38,84±4,47 <0,001 |
Расчет корреляционного анализа степени гемолиза эритроцитов и содержания гидроперекисей в плазме крови показал, что у крыс, получавших аквадетрим коэффициент корреляции (r) был равен 0,747 (р<0,01), а у животных c удаленными паращитовидными железами – 0,717 (р<0,02). То есть, отмечалась сильная положительная степень корреляции при гиперкальциемии и такая же, но отрицательная, при гипокальциемии. По отношению к уровню малонового диальдегида степень корреляции была средней и r составлял 0,644 (р<0,05) и 0,678 (р<0,05) соответственно. А то, что корреляционные связи осмотической стойкости мембран эритроцитов оказались более выраженными с содержанием гидроперекисей, очевидно, обусловлено первичностью накопления этих липидных радикалов.
Степень корреляционной связи с активностью ферментов антиоксидантной защиты оказалась слабой: для каталазы r=0,484 (положительная при гиперкальциемии) и 0,465 (отрицательная при гипокальциемии); для супероксиддисмутазы – 0,396 и 0,405 соответственно.
Таким образом, ежедневное внутрижелудочное введение крысам витамина D (аквадетрима в дозе 10 000 МЕ/100 г) в течение двух недель, приводящее к повышению содержания кальция в плазме крови, и экспериментальная гипокальциемия, созданная путем удаления паращитовидных желез, ослабляют осмотическую резистентность мембран эритроцитов, при этом, отмечаются корреляционные зависимости с усилившимся перекисным окислением липидов (сильная, положительная при гиперкальциемии и отрицательная при гипокальциемии) и ослаблением антиоксидантной защитой (слабая, аналогичная).
Рецензенты:
Дзугкоева Ф.С., д.м.н, профессор, заместитель директора Института биомедицинских исследований Владикавказского научного центра РАН и Правительства Республики Северная Осетия – Алания, г.Владикавказ.
Брин В.Б., д.м.н., профессор, заведующий кафедрой нормальной физиологии Северо-Осетинской государственной медицинской академии, г.Владикавказ.



