Чрезмерные физические нагрузки часто встречаются в практике физической культуры, спорта, в военном деле и на тяжелом производстве [4; 5]. Доказано, что физические нагрузки, превышающие оптимальный порог, приводят к активации свободно-радикальных процессов [5; 8; 10]. Это выражается в изменении биохимических показателей, характеризующих степень повреждения органов и тканей свободными радикалами. Наиболее вероятным источником свободных радикалов при чрезмерных физических нагрузках, на наш взгляд, может быть ксантиноксидазная реакция.
Образование в ксантиноксидазой реакции активированных кислородных метаболитов возможно в результате двухэлектронного восстановления FAD [7]. В зависимости от степени восстановления данного энзима, существует несколько десятков его промежуточных состояний. Это способствует усиленной продукции ксантиноксидазой активированных кислородных метаболитов при изменении функционального состояния клеток [7]. В частности, известно, что доля одноэлектронного восстановления данным ферментом кислорода увеличивается при сдвиге рН в кислую сторону [3]. Активация ксантиноксидазной реакции происходит после конверсии дегидрогеназной формы фермента в оксидазную [3; 7]. При избытке активированных кислородных метаболитов и недостатке антиоксидантов в организме развивается перекисное окисление липидов, углеводов, нуклеиновых кислот, белков, в том числе ферментов, что является причиной нарушения метаболизма во многих органах и тканях [7; 8; 10].
Кроме того, большую роль исследователи уделяют изучению параметров антиоксидантной защиты организма при действии на него чрезмерных физических нагрузок. Одним из основных антиоксидантов организма является глутатион. В научной литературе недостаточно освещен вопрос о содержании этого трипептида в почках крыс, подверженных чрезмерным физическим нагрузкам. Также отсутствует информация об активности ферментов, участвующих в его метаболизме в этих условиях. В связи с этим актуальным является изучение активности энзимов, участвующих в реализации глутатионового редокс-цикла при чрезмерных физических нагрузках.
Цель работы: оценить уровень глутатиона и активность ферментов его обмена в почках крыс при действии на организм чрезмерных физических нагрузок.
Материал и методы исследования
Исследования проводились на кафедре биохимии Омской государственной медицинской академии в 2011–2013 гг. В качестве экспериментальных животных были использованы 30 белых аутбредных крыс-самцов массой 180–200 г. При проведении эксперимента соблюдались требования Европейской конвенции по защите позвоночных животных, применяемых для экспериментальных и других научных целей 86/609 EEC. Физические нагрузки у крыс моделировали по В.В. Корняковой с соавт., 2007 [4]. Методом случайной выборки крыс делили на 2 группы (n=15). 1-ю группу составляли контрольные животные, которые плавали без груза по усредненному времени (3–5 мин), через день, в течение всего эксперимента, длившегося пять недель. 2-ю – крысы с чрезмерным режимом физической нагрузки, они плавали с грузом 10% от массы тела до полного утомления. Необходимо отметить, что на протяжении первых трех недель животные плавали через день, а последние две – ежедневно. Температура воздуха в виварии составляла 19–21 °С, воды при плавании – 28–30 °С.
После завершения эксперимента проводилось извлечение почек, которые позднее подвергались гомогенизации на 0,15 М растворе хлорида калия (KCl) в стеклянном гомогенизаторе Поттера при температуре 0–2 °С. В супернатанте гомогенатов определяли содержание общего белка при помощи биуретового реактива и глутатиона по Н.А. Костромитикову, Е.А. Суменкову (2005) [6]. Данный метод основан на реакции восстановленного глутатиона с реактивом Эллмана, в результате которого образуется тионитрофенольный анион, и под его воздействием меняется цвет раствора, приобретая желтый оттенок.
Активность глутатионпероксидазы (КФ 1.11.1.9) определяли по накоплению окисленного глутатиона [2]. В состав реакционной смеси входили: 1 мл фосфатного буфера (0,3 М pH 7,4); азид натрия 12 мМ глутатиона восстановленного, 0,2 мл гомогената, 0,5 мл 1,8 мМ перекиси водорода. Реакцию запускали добавлением перекиси водорода, останавливали через 2 мин добавлением 1 мл 10%-ной трихлоруксусной кислоты. После центрифугирования, при 3000 об/мин в течение 15 мин, определяли экстинкцию окисленного глутатиона при длине волны 260 нм. Активность глутатионредуктазы (КФ 1.6.4.2) определяли по скорости восстановления глутатиона в реакционной среде, содержащей 2 мл фосфатного буфера (0,05 М pH 8,0) 0,2 мл 1 мМ ЭДТА, 0,5 мл 7,5 мМ глутатион окисленный, 0,2 мл гомогената, 0,1 мл 1,2 мМ NADPH при 37 °С в течение 10 мин при длине волны 340 [2]. Активность гамма-глутамилтрансферазы (КФ 2.3.2.2.) определяли при помощи набора реактивов Chronolab (Швейцария).
Статистическую обработку полученных данных проводили с использованием программы Statistica 6.0 фирмы StatSoft Inc. (США). Экспериментальные данные обрабатывали при помощи непараметрического U–критерия Манна–Уитни. Результаты представлены как Ме – медиана, Q1 – нижний квартиль, Q3 – верхний квартиль.
Результаты исследования и их обсуждение
Результаты исследования представлены в табл. 1. Из нее видно, что влияние чрезмерных физических нагрузок на организм животных вызвало снижение концентрации глутатиона и изменение активности ферментов, участвующих в его метаболизме. Концентрация глутатиона в почках крыс второй группы снижена в 2,14 раза (pU=0,0017) относительно аналогичного показателя в контрольной группе. Данное снижение, на наш взгляд, является следствием усиленного катаболизма пуриновых мононуклеотидов до гипоксантина и дальнейшего его окисления до мочевой кислоты. Этот процесс сопряжен с усиленной генерацией ксантиноксидазой активированных кислородных метаболитов, истощающих антиоксидантную систему и приводящих к чрезмерной липопероксидации мембранных структур клеток почек (рис. 1).
Таблица 1
Содержание глутатиона и активность ферментов его обмена в почках крыс при действии на организм чрезмерных физических нагрузок, (Me (Q1–Q3)), n=15
|
Показатель |
Группа |
|
|
Контроль |
Чрезмерные физические нагрузки |
|
|
Глутатион, нмоль/мг белка |
15,7 (11,9–18,4) |
7,34* (4,73–10,7) pU=0,0017 |
|
Глутатионпероксидаза, МЕ/мг белка |
395 (339–431) |
149* (110–187) pU =0,0014 |
|
Глутатионредуктаза, МЕ/мг белка |
258 (231–324) |
93,8* (82,6–115) pU =0,0136 |
|
Гамма-глутамилтрансфераза, МЕ/мг белка |
439 (374–508) |
953* (861–1041) pU =0,0011 |
Примечание: * – различия статистически значимы с контролем; Ме – медиана; Q1 – нижний квартиль; Q3 – верхний квартиль; n – количество крыс в группе; pU – уровень статистической значимости различий.
Усиление катаболизма пуринов при чрезмерных физических нагрузках связано с активацией анаэробного гликолиза, развивающегося под влиянием гипоксии в этих условиях [3]. Усиление анаэробного пути катаболизма глюкозы, с одной стороны, приводит к ее дефициту, а с другой - к накоплению лактата. Увеличение уровня молочной кислоты активирует ферменты, катализирующие распад пуринов, а развившийся дефицит глюкозы в этих условиях тормозит работу гексозомонофосфатного пути ее превращения, что ведет к снижению выработки рибозо-5-фосфата, необходимого для реутилизации пуриновых мононуклеотидов [3]. Необходимо отметить, что угнетение работы пентозного цикла в условиях гипоксии ведет к снижению регенерации NADPH, необходимого для продуктивной работы глутатионредуктазы.
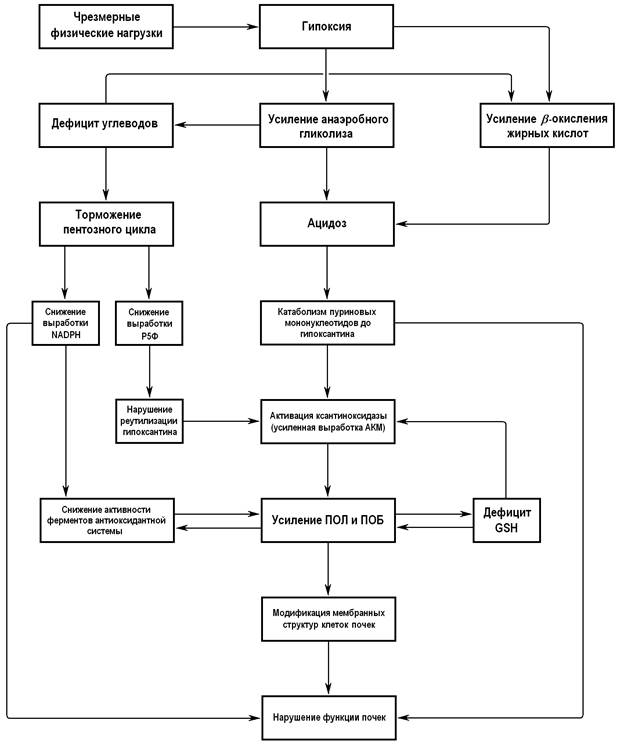
Рис. 1. Схема метаболических нарушений в почках крыс при чрезмерных физических нагрузках
Примечание: GSH – глутатион восстановленный; NADPH – никотинамидадениндинуклеотидфосфат восстановленный; АКМ – активированные кислородные метаболиты; ПОБ – перекисное окисление белков; ПОЛ – перекисное окисление липидов; Р5Ф – рибозо-5-фосфат.
Активность глутатионпероксидазы и глутатионредуктазы в почках крыс, подвергшихся чрезмерным физическим нагрузкам, снизилась в 2,65 (pU=0,0014) и 2,75 (pU=0,0136) раза относительно аналогичных показателей в контрольной группе соответственно. Глутатионпероксидаза катализирует реакции обезвреживания пероксида водорода (H2O2) и гидроперекисей липидов, образующихся в биологических мембранах под действием активированных кислородных метаболитов [7]. На первом этапе глутатионпероксидазной реакции происходит восстановление гидропероксида ненасыщенной жирной кислоты протоном до ее гидроокиси. Селенол при этом окисляется в селененовую кислоту ГПО-SeОН. «Окисленный» энзим в дальнейшем образует с глутатионом комплекс ГПО-SeG, реагирующий в дальнейшем со второй молекулой глутатиона с образованием глутатиондисульфида и исходной формы селенола в активном центре глутатионпероксидазы. Окислительно-восстановительные превращения атомов селена сочетаются с конформационными изменениями белковой части молекулы фермента. Образовавшиеся в результате реакции гидроокиси жирных кислот представляют для клеток меньшую опасность и способны катаболизироваться [7]. Глутатионредуктаза регенерирует глутатиондисульфид, образующийся в глутатионпероксидазной реакции, до глутатиона с использованием NADPH.
Значительное снижение активности глутатионпероксидазы и глутатионредуктазы в почках при действии на организм чрезмерных физических нагрузок может быть обусловлено несколькими факторами. Во-первых, для функционирования глутатионзависимых ферментов необходимо достаточное количество восстановленного NADPH. Во-вторых, молекулы ферментов, в частности их активные центры, могут быть «атакованы» свободными радикалами, образующимися в процессе усиленного катаболизма пуринов. Выше нами были описаны механизмы, способствующие угнетению процесса восстановления NADP+ до NADPH и способствующие нарушению обмена пуриновых мононуклеотидов. В-третьих, поскольку глутатионпероксидаза является селенопротеином, то может быть нарушена экспрессия ее генов вследствие дефицита селена, развившегося в условиях чрезмерных физических нагрузок. Данные о том, что во время интенсивных физических нагрузок организм теряет большое количество микроэлементов, в том числе и селена, приведены в работе [1].
Активность гамма-глутамилтрансферазы в почках крыс второй группы увеличилась в 2,17 (pU=0,0011) раза в сравнении с аналогичным показателем в контроле. Активация гамма-глутамилтрансферазы может быть связана с отрывом этого фермента от мембраны, на которой он находится, и накоплением его в цитоплазме. Многие авторы считают такое явление прямым следствием окислительного стресса [9]. Мы полагаем, что активация гамма-глутамилтрансферазы в данных условиях может усугубить нарушение глутатионового редокс-цикла в тканях почек.
Выводы
-
Чрезмерные физические нагрузки, моделируемые у экспериментальных животных, приводят к снижению уровня восстановленного глутатиона в тканях почек.
-
Активность глутатионпероксидазы и глутатионредуктазы в почках крыс при действии на организм чрезмерных физических нагрузок снижена на фоне повышения активности гамма-глутамилтрансферазы.
-
Уменьшение содержания глутатиона и изменение активности ферментов его обмена в почках крыс свидетельствуют о нарушении внутриклеточного редокс-потенциала при чрезмерных физических нагрузках.
Рецензенты:
Патюков А.Г., д.м.н., профессор, проректор по учебной работе, заведующий кафедрой нормальной физиологии ГБОУ ВПО «ОмГМА» Минздрава РФ, г. Омск.
Аглетдинов Э.Ф., д.м.н., профессор кафедры биологической и биоорганической химии ГБОУ ВПО «БГМУ» Минздрава РФ, г. Уфа.



