Введение
В настоящее время происходит сокращение объема фундаментальных естественнонаучных дисциплин в содержании и школьного, и высшего образования. Ситуация обостряется тем, что в классификациях естественных наук многие авторы не выделяют химию в качестве самостоятельной науки, ее редуцируют ("сводят") к физике [4]. Вместе с тем, еще в 1899 г. Д.И. Менделеев в предисловии к "Истории химии" Э. Мейера писал, что химия "выработала и продолжает развивать свой кругозор, который идет в параллель с чисто механическим и обещает его пополнить, хотя и доныне еще многие желают всю химию подчинить чисто механическим представлениям. Но, если науки об организмах приводят к пониманию индивидуальных особенностей, а науки физико-механического содержания стараются совершенно устранить это понятие об индивидуализме, то химия, уже своим учением о самостоятельности химических элементов, очевидно, занимает срединное положение, оправдывающее тот интерес, который она представляет для философской мысли".
Химики высказывают по этому вопросу полярные мнения. Например, утверждается [3], что "сущность химии как фундаментальной науки заключена в теоретических представлениях, имеющих не только неэмпирический, но в не меньшей степени полуэмпирический и эмпирический характер". Авторы учебного пособия [2] считают химию отдельной наукой, поскольку она имеет "своеобразный, уникальный предмет изучения - колоссальное разнообразие веществ" и, более того, "сама создает свой предмет. ... Физика изучает законы природы, биология - законы жизни, все это существует и без нас. А химики изучают то, что сделали, придумали, синтезировали и изучили сами". В то же время, основные законы химии (Периодический закон, закон сохранения и закон действующих масс) названы авторами "проекцией" законов физики на химические явления". Согласиться с такой трактовкой нельзя: материальный мир, состоящий из химических веществ, существует объективно. Его исследование методами химии является необходимым условием выживания человечества.
Отдельные науки отличаются, прежде всего, методами исследования и наличием проблемно-ориентированных языков. Рассмотрим особенности методов классической химии.
Методология химических исследований.
Свойства и строение вещества в химии устанавливают по результатам превращений. Например, строение карбидов урана UC2 и европия EuC2 можно установить по продуктам их взаимодействия с водой. При гидролизе этих соединений кристаллические исходные реагенты превращаются в аморфные и наблюдается выделение газообразных компонентов. По плотности газов относительно воздуха определяют молекулярную массу газов. Установлено, что при гидролизе карбида урана выделяется этилен С2Н4, а при гидролизе карбида европия - ацетилен С2Н2. Понятно, что в исходных карбидах атомы металлов занимают места, по которым при гидролизе к фрагментам С=С и С≡С присоединились атомы водорода. Следовательно, степени окисления урана и европия в карбидах равны +4 и +2, соответственно, а реакции гидролиза записываются в виде
UC2 (тв) + 4Н2О (ж.) = U(OH)4 (тв) + С2Н4 (газ)
EuC2 (тв) + 2Н2О (ж.) = Eu(OH)2 (тв) + С2Н2 (газ)
Разнообразие признаков, свидетельствующих о происходящих в системе химических превращениях, с использованием соответствующей базы справочных данных, позволяет расшифровать продукты превращения. В химическом опыте «вулкан» мы можем наблюдать изменение цвета соединений хрома и это свидетельствует об изменении его степени окисления, выделение газообразных веществ, паров воды, тепла.
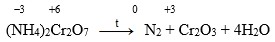
Этот метод исследования нобелевский лауреат в области физики Р. Фейнман охарактеризовал следующим образом [9]: "Чтобы узнать, как расположены атомы в какой-нибудь невероятно сложной молекуле, химик смотрит, что будет, если смешать два разных вещества. Да физик нипочем не поверит, что химик, описывая расположение атомов, понимает, о чем говорит. Но вот ... появился физический метод, который позволяет разглядывать молекулу ... и описывать расположение атомов не по цвету раствора, а по измерению расстояний между атомами. И что же? Оказалось, что химики почти никогда не ошибаются".
Особенности языка и логики химии. Обычно под языком химии понимают химические символы элементов, формулы соединений, уравнения реакций, номенклатуры названий. С позиций семиотики (науки о знаковых системах) вещества можно рассматривать как знаки, химические значения (свойства) которых устанавливают по результатам превращений в тех или иных химических системах [7]. При этом свойства того или иного вещества устанавливают относительно других веществ. Естественно, что в этой логике отношений многие вещества проявляют свойства, которые отражаются в химической терминологии терминами, которые являются антонимами.
В химии широко представлены кислотно-основные взаимодействия, рассмотрение которых проводят с различных позиций. В терминологии нобелевского лауреата С. Аррениуса кислоты - вещества, при электролитической диссоциации которых в водных растворах отщепляются протоны, а основания - вещества, продуцирующие при диссоциации ионы гидроксила. Были выделены гидроксиды металлов, которые проявляют свойства и кислот, и оснований. Например, относительно кислоты в реакции
Al(OH)3 + 3HCl = AlCl3 + 3H2O
гидроксид алюминия проявляет свойства основания, а относительно основания в реакции
Al(OH)3 + NaOH = Na[Al(OH)4]
проявляет свойства кислоты. Это явление кислотно-основной двойственности в химии (амфотерность) в школьном курсе химии рассматривается как исключение. Однако оно является скорее правилом, чем исключением.
Рассмотрим кислотно-основные взаимодействия в различных средах на основе представлений Бренстеда-Лоури. Здесь кислота рассматривается как вещество, состоящее из молекул или ионов - доноров протонов, а основание - как вещество, состоящее из молекул или ионов - акцепторов протонов. Установлено, например, что в различных растворителях молекулы воды проявляют химическую двойственность. Так, при взаимодействии в жидком аммиаке
NH3 (ж) + Н2О (ж) = NH4+(раствор) + ОН- (раствор)
вода проявляется свойства сильной кислоты, а в жидком фтороводороде
HF (ж) + Н2О (ж) = H3O+ (раствор) + F- (раствор)
она проявляет свойства сильного основания.
Не менее интересны результаты качественного определения структуры ассоциатов, которые образуются в жидкой воде. Согласно оценкам, сделанным по различным экспериментальным данным, число водородных связей, приходящихся на молекулу воды, больше двух. Можно полагать, что в воде существует какое-то количество тримеров воды.
В структуре тримера (рис.1) молекула воды (1) согласно представлениям Бренстеда-Лоури является основанием, молекула (3) - кислотой, а молекула (2) - и кислотой, и основанием.
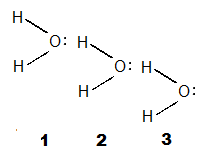
Рис.1. Структурная формула тримера воды
Бифункциональность присуща структуре многих веществ, в частности, аминокислот. В том, что эти соединения существуют не только в молекулярной форме HO(O)C-CH2-NH2, но и в виде цвиттерионов -O(O)C-CH2-NH3+ , можно убедиться на примере простейшей аминокислоты - глицина
Проявление веществами противоположных свойств характерно не только для кислотно-основных, но и для других химических свойств. Так, электролитическая диссоциация веществ во многом определяется природой растворителя. Например, хлороводород в воде является сильным электролитом, в этиловом спирте - слабым электролитом, а в бензоле - неэлектролитом.
Многие вещества проявляют противоположные свойства в окислительно-восстановительных реакциях. Например, пероксид водорода в водных растворах, содержащих иодид-ионы, в реакции
2KI + H2O2 + H2SO4 = I2 + K2SO4 + 2H2O
принимает электроны, то есть является окислителем. В системах H2O2 с перманганатом калия протекает реакция
5 H2O2 + 2KMnO4 + 3H2SO4 = 2MnSO4 + K2SO4 + 5O2 + 8Н2О,
то есть пероксид водорода является восстановителем.
Продукты окислительно-восстановительных реакций зависят от водородного показателя среды, что иллюстрируется следующими уравнениями
2KMnO4 + 5Na2SO3 + 3H2SO4 = 2MnSO4 + 5Na2SO4 + K2SO4 + 2H2O
2KMnO4 + 3Na2SO3 + H2O = 2MnO2 ↓ + 3Na2SO4 + 2KOH
2KMnO4 + Na2SO3 + 2KOH = 2K2MnO4 + Na2SO3 + H2O
В этих реакциях образующиеся продукты превращения легко распознаются по цвету раствора и образованию осадка MnO2.
Приведенные примеры свидетельствуют о том, что утверждения типа (либо..., либо...), характерные для формальной логики, в логике отношений, свойственной химии, сменяют утверждениями типа (и ..., и ...), содержащими термины - антонимы. Эту особенность логики химии обычно не доводят до сведения школьников и студентов. В результате для многих людей химия остается трудной для понимания наукой. Понятно, что закон исключенного третьего формальной логики в химии можно использовать лишь для полностью охарактеризованных химических систем. Например, без указания реагента, относительно которого устанавливается свойство, некорректен, например, следующий вопрос: является ли гидроксид цинка Zn(OH)2 кислотой или основанием?
Принцип дополнительности. Открытие дуализма «волна-частица» в квантовой физике потребовало для его объяснения больших усилий выдающихся физиков. В 1927 г. нобелевский лауреат Н. Бор сформулировал принцип дополнительности, согласно которому, для полного описания квантово-механических явлений необходимо применять два взаимоисключающих («дополнительных») набора классических понятий, совокупность которых даёт исчерпывающую информацию об этих явлениях как о целостных.
Тейяр де Шарден [10] утверждал, что какой-либо феномен, точно установленный хотя бы в одном месте, в силу фундаментального единства мира имеет повсеместные корни и всеобщее содержание. Действительно, необходимость использования для целостного описания химических свойств вещества набора различных, в том числе и противоположных терминов, установлена в химии еще в XIX веке.
История науки свидетельствует о том, что многие открытия химиков стимулировали развитие и становление новых разделов физики. Ряд явлений, например, высокотемпературная сверхпроводимость до настоящего времен не имеет общепринятого теоретического объяснения. Не до конца выявлена природа химической связи в металлокластерах, первый представитель которых Ta6Cl14.7H2O был получен в 1907 г. Между тем, в перспективе ожидается открытие порядка 109 индивидуальных соединений этого класса [1]. В [8] отмечено, что "структурная химия кластеров соединяет новизну строительных принципов и совершенство геометрических форм молекул и ионов, содержащих неслыханные для прочих классов веществ, фрагменты: полиэдры из атомов металла, скрепленные связями металл-металл".
Известно, что для адекватной фиксации знания в языковой реальности необходимо множество языков. Ю.М. Лотман подчеркнул [5]: «Минимальной работающей структурой является наличие двух языков и их неспособность, каждого в отдельности, охватить внешний мир. Сама эта неспособность есть не недостаток, а условие существования, именно она диктует необходимость другого (другой личности, другого языка, другой культуры). Представления об оптимальной модели с одним предельно совершенным языком заменяется образом структуры с минимально двумя, а фактически с открытым списком разных языков, взаимно необходимых друг другу в силу неспособности каждого в отдельности выразить мир. Языки эти как накладываются друг на друга, по-разному отражая одно и то же, так и располагаются «в одной плоскости», образуя в ней внутренние границы. Их взаимная непереводимость (или ограниченная переводимость) является источником адекватности внеязыкового объекта его отражению в мире языков».
Рассмотрение химии с позиций семиотики свидетельствует о том, что эта наука имеет свои методы исследования вещества как специфической знаковой системы, а также проблемно ориентированный язык и прагматику. Нобелевский лауреат Н.Н. Семенов подчеркнул, что "химические превращения, то есть процессы получения из определенных веществ (сырья) новых веществ (продуктов), обладающих существенно новыми свойствами, являются основным и наиболее характерным предметом химии и как науки, и как производства" [6].
Таким образом, свойства вещества исследуются методами и химии, и физики, что соответствует принципу дополнительности и необходимости использования для познания мира и фиксации результатов в языковой реальности нескольких языков.
Рецензенты:
Щербаков В.В., д.х.н., профессор, декан факультета естественных наук, ФГБОУ ВПО «Российский химико-технологический университет имени Д.И. Менделеева», г.Москва.
Борман В.Д., д.ф.-м.н., профессор, заведующий кафедрой, Национальный исследовательский ядерный университет «МИФИ», г. Москва.
Голубев А.М., д.х.н., профессор, зав. кафедрой химии, МГТУ им. Н.Э. Баумана, г.Москва.



