Введение
Известно, что при залповой активности нервно-мышечных синапсов из АТФ в синаптической щели может образовываться аденозин и действовать на свои пресинаптические рецепторы, в частности на рецепторы A2A-типа. Вследствие того что на нервном окончании присутствуют различные типы аденозиновых рецепторов, влияние аденозина на вызванную активность синапсов не является однозначным [2].
Показано, что связывание аденозина с пресинаптическими А2А-рецепторами влечёт за собой усиление работы аденилатциклазы и последующую активацию РКА. В мотонейронах РКА обладает множеством мишеней, в том числе она способна фосфорилировать кальциевые каналы L-типа [5]. В нервно-мышечных синапсах этот тип кальциевых каналов обычно не принимает участия в регуляции выброса ацетилхолина [1]. Однако при определённых условиях L-тип кальциевых каналов может вовлекаться в работу синапса и тем самым облегчать секрецию медиатора [3]. В связи с этим нас интересовало, способен ли внутриклеточный молекулярный каскад, запускаемый при активации A2A-рецепторов, влиять на L-тип кальциевых каналов и за счёт этого усиливать выброс ацетилхолина в нервно-мышечных синапсах мыши.
Цели исследования
-
Выявить роль аденозиновых рецепторов А2А-типа в модулировании секреции ацетилхолина в нервно-мышечных синапсах мыши.
-
Проследить влияние каскада, реализуемого через А2А-рецепторы, на активность кальциевых каналов L-типа.
Материалы и методы
Исследование вызванной и спонтанной активности моторных синапсов мышей проводили на изолированных «рассеченных» нервно-мышечных препаратах диафрагмальной мышцы (m. diaphragma - n. phrenicus) при комнатной температуре (20°С). Препарат помещали в камеру объемом 4 мл и перфузировали оксигенированным оксигенированным (95% O2, 5% CO2) раствором Лайли для теплокровных животных (содержащим (мМ): NaCl - 135, NaHCO3 - 16.3, глюкоза - 11, KCl - 4, CaCl2 - 2, MgCl2 - 1, NaH2PO4 - 0.9; pH 7.2-7.4). Регистрацию миниатюрных потенциалов концевой пластинки (МПКП) и вызванных потенциалов концевой пластинки (ПКП) осуществляли внутриклеточно при помощи стандартной микроэлектродной техники отведения потенциалов. Для этого были использованы стеклянные (Pyrex) микроэлектроды, заполненные 2,5 М КCl (сопротивление кончика 10-15 МОм). При исследовании ритмической активности синапсов стимулировали диафрагмальный нерв короткими пачками сверхпороговых импульсов с частотой 50 Гц (в течение 1 секунды). Сигналы регистрировали при помощи усилителя Axoclamp-2B (Molecular Devices). Запись сигналов осуществлялась на жесткий диск компьютера с помощью аналого-цифрового преобразователя “L-Card Е-154” с интерфейсом “PowerGraph”. В каждой серии экспериментов использовали не менее трех нервно-мышечных препаратов. В контроле регистрировали миниатюрные потенциалы концевой пластинки (МПКП) и вызванные ПКП не менее чем в 5 разных синапсах. Затем в перфузирующий раствор в определенном порядке добавляли исследуемые вещества и проводили регистрацию электрических ответов от разных синапсов в течение 60-90 минут. Полученные данные обрабатывали в программе “MiniAnalysis” (Synaptosoft). Помимо определения средних значений амплитуд МПКП и ПКП, производили расчёт квантового состава ПКП (как отношение средней корректированной на нелинейную суммацию амплитуды ПКП к средней амплитуде МПКП). Достоверность различий между выборками оценивали по t-критерию Стьюдента и критерию Манна-Уитни. Уровень значимости (p) отличий между двумя выборками составлял 0,05 (n – количество исследованных синапсов).
В экспериментах использовали следующие фармакологические препараты:
Циклоспорин А (ингибитор кальцинейрина), EnzoLife Sciences©; ZM241385 (антагонист A2A-рецепторов), CGS-21680 (агонист А2А-рецепторов), оба препарата Sigma©.
Для приготовления маточных растворов всех препаратов в качестве растворителя использовали диметилсульфоксид (DMSO). Финальные концентрации DMSO в рабочем растворе составляли не более 0,05 % (v/v) и не оказывали самостоятельного действия на параметры спонтанной и вызванной активности в моторных синапсах мыши.
Результаты и обсуждение
Для выявления роли аденозиновых рецепторов А2А-типа в регуляции секреции ацетилхолина (АХ) в моторных синапсах мыши, в первой серии экспериментов мы проводили блокаду этих рецепторов при помощи их избирательного антагониста ZM241385 (10 нМ). При аппликации ZM241385 не происходило изменений ни средней амплитуды МПКП (в контроле 1,02±0,05 мВ (n=21), на фоне ZM241385 – 1,00±0,06 мВ (n=19, p>0,05)); ни квантового состава ПКП на всём протяжении залпа ПКП (квантовый состав первого ПКП в залпе составлял 30,77±1,45 (n=21) в контроле и 30,51±1,44 (n=19, p>0,05) на фоне блокатора). Значит, каскад, запускаемый при активации А2А-рецепторов, не оказывает выраженного облегчающего влияния на секрецию АХ.
Вероятно, роль этого каскада реакций может становиться более значимой при специальных условиях, например, при растормаживании L-типа кальциевых каналов. Известно, что можно добиться включения L-типа кальциевых каналов в регуляцию выброса АХ с помощью CsA, снимая тормозный контроль на эти каналы со стороны кальцинейрина, при этом происходит значительный прирост квантового состава ПКП [4]. Поэтому далее мы решили исследовать, играют ли А2А-рецепторы какую-либо роль в облегчении выброса АХ, происходящем при ингибировании кальцинейрина с помощью циклоспорина А (CsA).
Оказалось, что облегчающее действие CsA на вызванную секрецию АХ предотвращается аппликацией ZM241385 (Рис. 1).
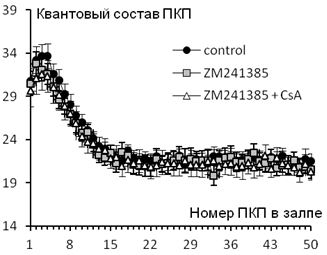
Рис. 1. Изменение квантового состава ПКП по ходу короткого ритмического залпа (50 Гц) в контроле (n=21), на фоне 10 нМ ZM241385 (n=19) и при действии 1 мкМ CsA на фоне ZM241385 (n=18).
Следовательно, внутриклеточный каскад, запускаемый активацией А2А-рецепторов эндогенным аденозином, и кальцинейрин функционально антагонистичны и имеют общую мишень – L-тип кальциевых каналов. Причем, в норме доминирует тормозное тоническое подавление работы L-типа каналов со стороны кальцинейрина, несмотря на одновременное активирующее действие со стороны А2А-рецепторов. При этом, как мы впервые установили, для демаскирования L-типа кальциевых каналов необходимым условием является не только ингибирование кальцинейрина, но и одновременная активность А2А-рецепторов.
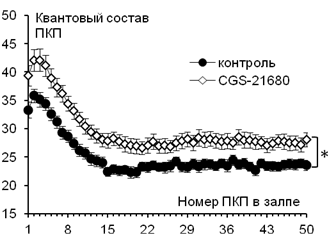
Рис. 2. Изменение квантового состава ПКП по ходу короткого ритмического залпа (50 Гц) в контроле (n=19) и на фоне действия 1 мкМ CGS-21680 (n=28). * - p<0,05.
Мы предположили, что усиление сигнализации через А2А-рецепторы способно приводить к сдвигу баланса регуляторных воздействий на L-тип кальциевых каналов в сторону потенцирования их работы в противовес тормозному влиянию кальцинейрина на эти каналы.
Аппликация селективного агониста А2А-рецепторов CGS-21680 (1 мкМ) приводила к приросту квантового состава ПКП по всему ходу залпа (Рис. 2).
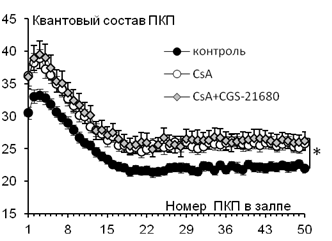
Рис. 3. Изменение квантового состава ПКП по ходу короткого ритмического залпа (50 Гц) в контроле (n=29), на фоне 1 мкМ CsA (n=34) и при действии 1 мкМ CGS-21680 (n=28) на фоне CsA.* - p<0,05
Квантовый состав первого ПКП в залпе составил 33,29±1,41 (n=19) в контроле, а на фоне CGS-21680 (1 мкМ) – 39,42±1,81 (n=28, p<0,05). При этом амплитуда МПКП достоверно не изменялась и равнялась 0,95±0,05 мВ в контроле и 1,05±0,05 мВ (p>0,05) на фоне действия CGS-21680.
То есть каскад реакций, запускаемый экзогенным агонистом А2А-рецепторов, участвует в облегчении вызванной секреции АХ, несмотря на присутствие функционально активного кальцинейрина в терминали.
Нас интересовало, играет ли растормаживание L-типа кальциевых каналов ключевую роль в каскаде, осуществляемом при активации А2А-типа рецепторов экзогенным агонистом, или же действие этих рецепторов на нервно-мышечную передачу может реализовываться и другими путями. Поэтому далее мы исследовали влияние агониста А2А-рецепторов CGS-21680 (1 мкМ) на фоне демаскирования кальциевых каналов L-типа при действии CsА (1 мкМ).
При аппликации CsА квантовый состав каждого ПКП в залпе увеличивался по сравнению с контролем (для первого ПКП в залпе от 30,51±0,92 (n=29) до 36,26±1,57 (n=34, p<0,05)). На фоне CsА добавление CGS-21680 не вызывало дополнительного прироста квантового состава ПКП в залпе (Рис. 3). Амплитуда МПКП не претерпевала достоверных изменений на протяжении всего эксперимента (в контроле – 1,02±0,04 мВ (n=29), под влиянием CsА – 1,09±0,04 мВ (n=34), при действии CGS-21680 на фоне CsА – 1,14±0,05 (n=27, p>0,05)).
Таким образом, если L-тип кальциевых каналов уже демаскирован (за счет снятия тормозного действия кальцнейрина и присутствия активирующего действия эндогенного аденозина на L-тип каналов), то дополнительная активация А2А-рецепторов их экзогенным агонистом уже не приводит к дополнительному усилению секреции медиатора. Отсюда следует, что основной мишенью внутриклеточного каскада реакций, начинающегося с А2А-рецепторов, действительно являются кальциевые каналы L-типа.
Заключение
Итак, нами показано участие пресинаптических аденозиновых рецепторов А2А-типа в модуляции секреции ацетилхолина в нервно-мышечных синапсах мыши в условиях короткого ритмического залпа. Активация А2А рецепторов экзогенным агонистом приводит к облегчению выброса медиатора, связанного с растормаживанием L-типа кальциевых каналов терминалей. Вместе с тем, активация А2А-рецепторов эндогенным аденозином сама по себе не достаточна для облегчения передачи, но необходима для растормаживания кальциевых каналов L-типа и последующего облегчения выброса АХ при блокаде фосфатазы кальцинейрина.
Рецензенты:
Гудков С.В., д.б.н, в.н.с., Федеральное Государственное Бюджетное Учреждение Науки Институт Теоретической и Экспериментальной Биофизики РАН (ИТЭБ РАН), г. Москва.
Белова Н.А., д.б.н, в.н.с., Федеральное Государственное Бюджетное Учреждение Науки Институт Теоретической и Экспериментальной Биофизики РАН (ИТЭБ РАН), г. Москва.



